Operativ og endovaskulær behandling av carotisstenose – når er det aktuelt?
Background.
Stroke is the most common cause of disability in Norway. Most strokes are ischemic, and 25 – 30 % are caused by emboli from atherosclerotic plaques in pre-cerebral arteries. The aim of this study was to review the literature on effectiveness of stroke prevention by surgical and endovascular treatment of carotid bifurcation stenoses.
Material and methods
. Search of the PubMed and Cochrane Library. Relevant textbook chapters and personal experience have also supported the evaluation.
Results and interpretation
. Prevention of stroke by carotid endarterectomy is documented in several large randomised controlled trials. For carotid stenoses with reduced diameters of more than 50 %, a significant reduction of 5-year stroke risk is achieved with surgery and best medical treatment, compared to best medical treatment alone. The benefit is greatest with symptomatic stenoses, especially if surgery is performed shortly after onset of symptoms. Patients with transient ischemic attack (TIA), minor stroke or amaurosis fugax should without delay be referred to an ultrasound examination of the carotid. Surgery as soon as possible is indicated if > 70 % stenosis is found, and for men also with moderate stenoses (50 – 69 %). The benefit is less pronounced for women with moderate stenosis and they should be considered individually. In asymptomatic patients, surgery reduces the 5-year stroke risk from 11.8 to 6.4 %. The indication for surgery in asymptomatic patients must be balanced against age, co-morbidity, and the quality of surgery at each centre. A low operative morbidity is a prerequisite. No comparable evidence exists for endovascular treatment, and it is recommended that patients eligible for stent treatment are included in ongoing randomised trials comparing stent treatment and endarterectomy.
I Norge forekommer det ca. 12 000 – 15 000 hjerneslag hvert år. Om lag en av tre pasienter har hatt slag før. Hjerneslag er den vanligste årsaken til invaliditet og den tredje vanligste dødsårsaken i Norge. Insidens øker med økende alder, og er 1,5 ganger høyere hos menn enn hos kvinner. 80 % er iskemiske slag (hjerneinfarkter), og man regner med at 25 – 30 % av disse skyldes aterosklerose i precerebrale arterier (1). Hensikten med denne oversiktsartikkelen er å gjennomgå dokumentasjon vedrørende slagforebyggende effekt av kirurgisk og endovaskulær behandling av carotisstenoser og drøfte konsekvenser for klinisk praksis.
Materiale og metode
Artikkelen er basert på søk i PubMed og Cochrane-databasen etter publikasjoner om emnet, dessuten relevante lærebokkapitler og egne erfaringer. Det er gjort flere store randomiserte kontrollerte kliniske studier i løpet av de siste 20 år, og disse er inkludert.
Indikasjon for kirurgi
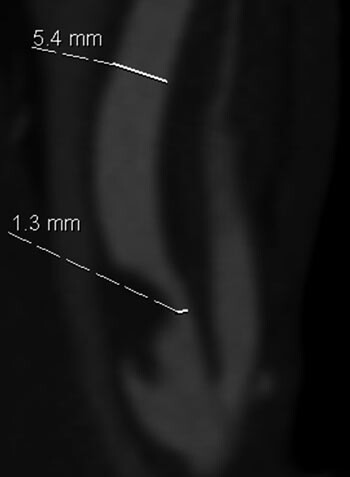
Det er svært god dokumentasjon på den slagforebyggende effekt av kirurgisk behandling ved symptomgivende carotisstenoser (2) – (6). To store randomiserte studier, European Carotid Surgery Trial (ECST) og North American Symptomatic Carotid Endarterectomy Trial (NASCET), inkluderte til sammen 5 950 pasienter med stenose i a. carotis interna og ipsilateralt transitorisk iskemisk anfall (TIA), ikke-invalidiserende slag eller amaurosis fugax. Pasientene ble randomisert til beste medisinske behandling alene eller beste medisinske behandling i tillegg til trombendarterektomi av a. carotis. Tid fra symptomtidspunkt til randomisering skulle ikke overstige 180 dager. I begge studiene ble inklusjon av pasienter med høygradige stenoser stoppet fordi interimresultat viste overbevisende effekt av kirurgi (2, 3). Inklusjon av pasienter med mer lavgradige stenoser fortsatte, og de endelige resultater ble presentert i 1998 (4, 5). For pasienter med > 50 % stenose, definert som diameterreduksjon i stenosen relatert til diameter i distale a. carotis interna (fig 1), gir trombendarterektomi og medisinsk behandling 29 – 69 % relativ risikoreduksjon for slag i løpet av 3 – 5 år sammenliknet med medikamentell behandling alene. Gevinsten øker med økende grad av stenose. Absolutt risikoreduksjon er 6,5 % og 19,4 % for stenoser med henholdsvis 50 – 69 % og 70 – 99 % reduksjon i diameter (tab 1) (2) – (5, 7) – (10). Perioperative slag og død er inkludert i dette, og var 7,0 % i ECST og 5,8 % i NASCET. Begge studiene konkluderer også med at pasienter med stenoser < 50 % ikke har nytte av kirurgisk behandling.
Tabell 1
Absolutt risikoreduksjon og relativ risikoreduksjon for hjerneslag ved trombendarterektomi (TEA) av a. carotis sammenliknet med medisinsk behandling (MB), og ved statinbehandling sammenliknet med placebo (7). Tabellen er basert på resultater fra European Carotid Surgery Trial (ECST) (2, 4), North American Symptomatic Carotid Endarterectomy Trial (NASCET) (3, 5), Asymptomatic Carotid Atherosclerosis Study (ACAS) (8), Asymptomatic Carotid Surgery Trial (ACST) (9) og Heart Protection Study (HPS) (10)
| Relativ risikoreduksjon (%) | Absolutt risikoreduksjon (%) | Intervensjon | Inklusjon | Antall pasienter behandlet for å forhindre ett slag (NNT) | Antall slag forhindret/1 000 pasienter | |
| HPS (5 år) | 24,6 | 1,4 | 40 mg simvastatin versus placebo | Hjerte-karsykdom eller diabetes | 71 | 14 |
| ACST (5 år) | 46 | 5,3 | TEA + MB versus MB | Asymptomatisk (ikke cerebrovaskulære symptomer siste 180 dager) | 19 | 53 |
| ACAS (5 år) | 54 | 5,9 | TEA + MB versus MB | Asymptomatisk (ikke cerebrovaskulære symptomer siste 180 dager) | 17 | 59 |
| NASCET 50 – 69 % (5 år) | 29 | 6,5 | TEA + MB versus MB | TIA/slag/amaurosis fugax | 15 | 67 |
| NASCET 70 – 99 % (3 år) | 69 | 19,4 | TEA + MB versus MB | TIA/slag/amaurosis fugax | 5 | 200 |
| ECST 70 – 99 % (5 år) | 45 | 8,5 | TEA + MB versus MB | TIA/slag/amaurosis fugax | 12 | 83 |
Effekt av kirurgi ved asymptomatiske stenoser > 60 % er dokumentert i to randomiserte studier: Asymptomatic Carotid Atherosclerosis Study (ACAS) og Asymptomatic Carotid Surgery Trial (ACST) (8, 9). Asymptomatiske stenoser defineres som stenoser som ikke har gitt symptomer (ipsilateral TIA, slag, amaurosis fugax) i løpet av de siste 180 dager før randomisering. Det er påvist en signifikant slagforebyggende effekt av kirurgisk behandling, med relativ risikoreduksjon 46 – 54 %, men effekten er tallmessig liten da absolutt risikoreduksjon er 5,4 – 5,9 % på fem år (tab 1), og forutsetningen for å oppnå dette er at perioperativ forekomst av slag og død er < 3 %. I ACST var forekomst av slag i en femårsperiode 11,8 % i gruppen med medisinsk behandling og 6,4 % i kirurgigruppen, inkludert 3 % perioperative slag. I motsetning til ved symptomatiske stenoser, kunne man ved asymptomatiske ikke påvise forskjell i effekt avhengig av stenosegrad (9).
Indikasjon for kirurgi
-
Pasienter med transitorisk iskemisk anfall (TIA), ikke-invalidiserende slag eller amaurosis fugax og ipsilateral carotisstenose > 70 % bør opereres innen to uker etter symptomer
-
Hos menn gjelder samme indikasjon også ved moderate stenoser (50 – 69 %)
-
Hos kvinner med moderate stenoser, og hos pasienter med stenoser > 60 %, men uten symptomer gir også kirurgisk behandling slagforebyggende effekt. Disse pasientene bør vurderes individuelt fordi effekten er tallmessig beskjeden og må veies opp mot økt operasjonsrisiko eller kort forventet levetid
Tidsaspektet
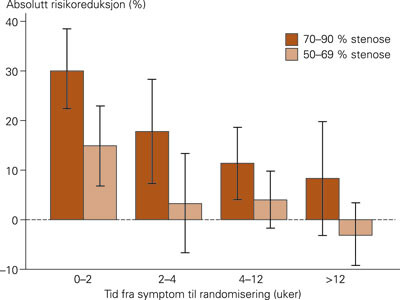
Symptomgivende stenose ble i disse studiene definert ved at tid fra symptom til randomisering var < 180 dager. Data fra ECST og NASCET er også analysert med tanke på om nytten av kirurgi er avhengig av ventetiden fra symptom til randomisering, og man fant at den slagforebyggende effekten var størst hos pasienter som ble randomisert < 2 uker etter siste symptom, og at dersom ventetiden ble > 12 uker, var effekten av kirurgi marginal (fig 2) (11). Det har tidligere vært vanlig praksis å anbefale å vente 4 – 6 uker med carotiskirurgi etter et slag på grunn av økt operasjonsrisiko. Slik økt risiko kunne ikke påvises hos pasienter som var inkludert i NASCET og ECST, og det anbefales nå at pasienter skal opereres innen to uker etter symptomer (11). Populasjonsstudier av slag har vist at av 2 416 pasienter med iskemiske hjerneslag, hadde 23 % forvarsel i form av TIA, og 43 % av disse anfallene inntraff i løpet av de siste sju dagene før slaget (12). Dette stiller nye krav til henvisningspraksis og organisering både i primærhelsetjenesten og i sykehusene. Pasienter bør henvises umiddelbart til vurdering for kirurgisk behandling.
Alder, kjønn og andre risikofaktorer
Det er gjort analyser av subgrupper for å vurdere hvilke pasienter som har mer og hvilke som har mindre nytte av kirurgisk behandling. I ACST var effekten av kirurgi signifikant ved femårs oppfølging for begge kjønn, men ikke for pasienter som var 75 år og eldre. Det var bare inkludert 650 pasienter i denne aldersgruppen, så dette kan være et falskt negativt resultat. Effekten for kvinner var signifikant (p = 0,02), men lavere enn for menn. Årsaken kan være at det var inkludert færre kvinner. Forekomst av perioperative slag/død var lik for alle grupper. Men fordi det er svært få slike hendelser, vil påliteligheten av subgruppeanalyser på for eksempel kjønn være begrenset. I ACST var også effekten av kirurgi uavhengig av blodtrykk, diabetes, koronarsykdom, plakkmorfologi bedømt med ultralyd, status for kontralateral carotisarterie, tidligere cerebrale symptomer (> 180 dager før randomisering), og kolesterolverdi.
I ECST fant man i gruppen «beste medisinske behandling» at gjennomgått slag (i motsetning til TIA eller amaurosis fugax), vedvarende nevrologisk sekvele eller infarkt på cerebral CT indikerte dårligere prognose (større risiko for slag i oppfølgingsperioden). I kirurgigruppen var høyt blodtrykk assosiert med høyere 30-dagers forekomst av slag/død. Det samme var kort operasjonstid (< 1 time). Operasjonsrisiko var ikke påvirket av alder, men var høyere for kvinner enn for menn.
I NASCET-studien økte operasjonsrisikoen hos pasienter med kontralateral okkludert carotisarterie, ipsilateralt cerebralt infarkt preoperativt påvist ved CT, diabetes og høyt blodtrykk, mens alder og kjønn ikke hadde betydning. Den slagforebyggende effekten var større hos pasienter med preoperativt slag enn med TIA, og større hos pasienter med hemisfæresymptomer enn med amaurosis fugax. Effekten var signifikant for menn ved alle grader av stenose > 50 %, mens kvinner ikke hadde signifikant effekt av kirurgi ved moderat stenosegrad (50 – 69 %).
En metaanalyse av ECST og NASCET viste at i tillegg til betydning av stenosegrad, var nytten av kirurgi størst for menn, for pasienter eldre enn 75 år, og for pasienter som hadde kort ventetid mellom symptom og randomisering (11).
Har bedre medikamentell behandling gjort kirurgi overflødig?
Dokumentasjon for nytten av kirurgi ved carotisstenose er overbevisende. Det innvendes likevel at det har skjedd store forbedringer innen farmakologisk profylakse siden randomiseringen startet i 1981 (ECST), og at man kunne fått et annet resultat dersom studiene kunne gjentas i dag.
British Heart Protection Study (HPS) der man sammenlikner bruk av simvastatin med placebo, viser at pasienter med hjerte- og karsykdom må bruke 40 mg simvastatin daglig i fem år for å redusere risikoen for iskemisk hjerneslag fra 5,7 % til 4,3 % (absolutt risikoreduksjon 1,4 %, relativ risikoreduksjon 25 %) (10) (tab 1). Effekten kommer imidlertid først etter andre behandlingsår. Det er også dokumentert at behandling med platehemmer og effektiv blodtrykksbehandling (ACE-hemmer) reduserer risikoen for slag (13) – (15). Studier av medikamentell profylakse angir relativ risikoreduksjon på 20 – 30 %, men absolutt risikoreduksjon er bare ca. 2 – 4 %. Det er imidlertid kjent at etterlevelse av medikamentforskrivning er mye lavere i klinisk praksis enn hos pasienter inkludert i studier, kanskje ned mot 40 – 50 % (7).
I ACST som er den nyeste av de store carotisstudiene, har praksis for beste medisinske behandling endret seg under studieperioden. I 1993 brukte 17 % statiner, mot 90 % i 2004. I 2003 brukte 90 % platehemmer og 81 % antihypertensiver. Medikamentbruken var lik i begge gruppene (9). Det var likevel signifikant slagforebyggende effekt av kirurgi opp til femårs oppfølging, og det er således ingen holdepunkter for at farmakologisk profylakse gjør kirurgi overflødig.
Hvordan beregnes stenosegrad?
Siden det er stenosegrad som bestemmer behandlingsindikasjon, er det viktig å se på hvordan denne måles. I ECST og NASCET ble stenosegrad angitt etter angiografi. Dette er en invasiv undersøkelse som i seg selv innebærer en risiko for slag på 0,1 % (5). I NASCET-studien angis stenosegrad som prosent diameterreduksjon i stenosen sammenliknet med diameter i a. carotis interna distalt for stenosen (fig 1). I ECST ble diameter i stenosen sammenliknet med en estimert ytre diameter (inkludert plakket) i bulbus caroticum. NASCET-metoden antas å være mer reproduserbar. Metaanalysen i Cochrane-databasen bruker formelen «ECST-measured % stenosis = 0,6 (NASCET-measured % stenosis) + 40 %» og tabeller for sammenlikning er publisert (tab 2) (6).
Tabell 2
Sammenlikning av prosentvis stenosegrad i ECST og NASCET. Formel: «ECST-measured % stenosis = 0,6 (NASCET-measured % stenosis) + 40 %» (6)
| Ikke indikasjon for kirurgi (%) | Kirurgi forebygger slag (%) | Ikke indikasjon for kirurgi (%) | |||||
| ECST | 50 | 58 | 70 | 82 | 99 | 100 | |
| NASCET | 17 | 30 | 50 | 70 | 99 | 100 | |
I ACST-studien ble pasienter inkludert på basis av stenosegradering med ultralyd. Dette består av måling av maksimal systolisk hastighet i a. carotis interna med dopplerteknikk samt plakkvisualisering med gråtoneskala og fargedoppler (16). Ultralyd er brukeravhengig, og reproduserbarhet og nøyaktighet er avhengig av utøverens kompetanse (17). Feilkilder oppstår også ved sykdom i arterien proksimalt eller distalt for carotisbifurkaturen og ved sykdom i kontralaterale carotis.
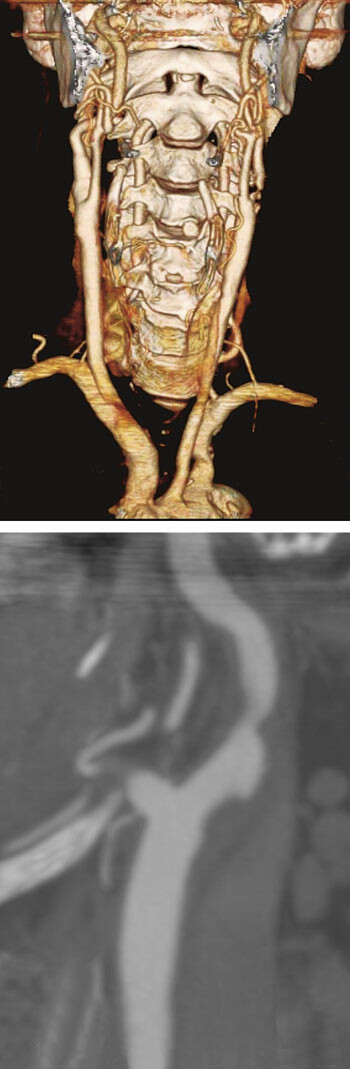
I de senere år har utvikling av MR- og CT-teknologi gitt nye muligheter for ikke-invasiv diagnostikk. CT-angiografi med moderne 64-kanalers spiral-CT gir detaljerte bilder av stenosen og forandringene i karveggen som tromber og kalk, og man får i samme skanning fremstilling av hele forløpet fra aortabuen til intracerebrale kar. Dette er nyttig i forhold til å vurdere egnethet for kirurgi eller stentbehandling. Hos oss henvises nå til ultralydundersøkelse av halskar som første screening, og CT-angiografi gjøres deretter som ledd i preoperativ planlegging. Vi benytter de aksiale originalsnittene til å måle karlumen og visualisere kalk, tromber og ulcerasjoner, for så ved hjelp av koronale og sagittale rekonstruksjoner å beregne stenosegrad på samme måte som ved konvensjonell angiografi (fig 3).
Plakkstabilitet
Økende grad av stenose indikerer økende risiko for slag. Etiologien for slag ved carotisstenose antas i de fleste tilfeller å være embolier pga. plakkruptur eller platetromber i ulcererte plakk. Angiografiundersøkelser i ECST-studien ble analysert for stenosegrad, men også plakkets overflate (grad av uregelmessighet og ulcerasjoner) ble karakterisert. I gruppen med beste medisinske behandling var økende grad av plakkuregelmessighet assosiert med økende risiko for slag i oppfølgingstiden, også uavhengig av stenosegrad (18). Forskning pågår for å finne en mer direkte evaluering av plakkstabilitet enn stenosegrad, som i dag er viktigste kriterium for operasjonsindikasjon. Plakkets stabilitet kan analyseres med ultralyd ved hjelp av gråtoneskala. Mørke plakk er «bløte» og ustabile, mens plakk som er lyse på ultralydbildet inneholder mer kalk og fibrotisk materiale og er mer stabile (19). Også med høyoppløselig MR og CT gjøres forsøk på å karakterisere plakkstabilitet. Ved transkranial dopplerundersøkelse kan embolier til intracerebrale kar registreres direkte. Pasienter med symptomgivende carotisstenoser og ipsilaterale cerebrale mikroembolier påvist med transkranial doppler har økt risiko for hjerneinfarkt. Stenosegrad og kliniske symptomer er hovedkriterier for operasjonsindikasjon, men supplerende metoder for vurdering av plakkstabilitet er nyttige i tvilstilfeller.
Operasjonsrisiko – sammenheng mellom volum og kvalitet?
Slagforebyggende effekt av carotiskirurgi er direkte avhengig av lav operasjonsrisiko. Ifølge metaanalyser bør kirurgi for symptomatiske stenoser gjøres med lavere 30-dagers risiko for slag/død enn 6 %, og ved asymptomatiske stenoser < 3 %. Hvis pasienten utsettes for høyere perioperativ risiko, elimineres langt på vei nytten av inngrepet. Pasienter og henvisende leger har lite informasjon om resultater ved de enkelte sykehus. I Norge blir carotisstenoser operert ved 15 – 18 sykehus, en tredel med et årlig volum på < 10 inngrep (20). Det er relativt god dokumentasjon på sammenheng mellom volum og kvalitet (20, 21). Norsk karkirurgisk forenings register NORKAR publiserer operasjonsvolum for de enkelte medlemssykehus (22), men kvalitetsdata bare samlet for landet. Det er vist at registeret underrapporterer både volum og forekomst av perioperative slag/død (23).
Kvalitet dreier seg om operative komplikasjoner, men også om riktig seleksjon av pasientene. Studiene viser statistisk signifikant effekt av kirurgi, men for grupper av pasienter er denne effekten i praksis marginal. Rådgivningen må individualiseres, også fordi et flertall av pasientene har andre kardiovaskulære manifestasjoner som påvirker både leveutsikter og operasjonsrisiko (24). Med et årlig volum i Norge på 200 – 250 behandlede carotisstenoser, bør slik behandling sentraliseres til regionsykehusene hvor det bør etableres tverrfaglige team. Sentralisering av denne behandlingen er også anbefalt i Sverige (25).
Behandling med stent
Endovaskulær behandling med stent ved carotisstenoser ble introdusert i midten av 1990-årene. Det er utviklet spesielle stenter og innføringssystemer, samt filtre eller okklusjonsballonger som plasseres i arterien distalt for stenosen for å fange opp embolier som oppstår ved prosedyren. Disse markedsføres som «protection device», selv om beskyttelseseffekt ennå ikke er dokumentert i kontrollerte studier. Flere små randomiserte studier for sammenlikning med trombendarterektomi har vist varierende resultater (26, 27). SAPPHIRE-studien ble publisert i 2004 (28). Pasientene var selektert på grunn av økt operasjonsrisiko, men likevel var > 70 % asymptomatiske i forhold til sin carotisstenose. Det var om lag 160 pasienter i hver gruppe. I tillegg til slag og død, ble også postoperativt hjerteinfarkt (definert ved stigning i kreatinkinasekonsentrasjon) registrert. Det var ingen signifikant forskjell mellom gruppene, bortsett fra ved ensidig testing etter ett år, da man konkluderte: «carotid stenting with the use of an emboli-protection device is not inferior to carotid endarterectomy» (28). Dersom bare slag og død ble vurdert, var det ingen forskjell. SAPPHIRE-studien er industrifinansiert av Cordis Corporation og resultatene er omdiskutert. En lederartikkel i Lancet Neurology kommenterte: «The industry’s apparent push to replace endarterectomy by a procedure that is yet to be proven in prospective, randomised trials has alarmed many stroke experts» (29). En tysk randomisert studie med 1 183 pasienter viste ingen forskjell mellom gruppene etter 30 dager (30). Både i Europa og USA inkluderes nå pasienter i industriuavhengige randomiserte studier, og Rikshospitalet deltar i International Carotid Stenting Study (ICSS) (31).
Multiple halskarstenoser, hypoperfusjon og vertebrobasilær insuffisiens
De store randomiserte studiene inkluderer pasienter med aterosklerose i carotisbifurkaturen og symptomer på, eller risiko for, cerebrale embolier. Ved symptomer på regional eller global hypoperfusjon, reversert blodstrøm (subclavian steal syndrome) og vertebrobasilær insuffisiens finnes ingen randomiserte studier som støtte for valg av behandling. Det samme gjelder ved andre årsaker til sykdom i precerebrale kar, som disseksjon, vaskulitt, fibromuskulær dysplasi, restenoser etter kirurgi og stenoser etter strålebehandling. Behandlingsindikasjon må vurderes individuelt. Klinisk nevrologisk vurdering er viktig, og de anatomiske forhold må kartlegges, inkludert kollateralsirkulasjon. Hemodynamiske forhold og hjernens vaskulære reservekapasitet kan vurderes med nukleærmedisinske metoder, transkranial dopplerundersøkelse og MR. Behandlingen kan være konservativ, endovaskulær eller åpen kirurgi, og pasienten bør vurderes i et multidisiplinært team som behersker alle muligheter.
Konklusjon
Den slagforebyggende effekten av carotiskirurgi er udiskutabel hos pasienter med symptomatiske trange stenoser (> 70 %), og hos menn med moderate stenoser (50 – 69 %). Effekten er også dokumentert og statistisk signifikant, men tallmessig mer beskjeden hos kvinner med symptomer og moderate stenoser, og hos pasienter med asymptomatiske stenoser > 60 %. Ved symptomatiske stenoser øker effekten av kirurgi med økende alder, og det settes ingen øvre aldersgrense. Operasjonen bør utføres raskt (< 2 uker) etter symptomer for å gi maksimal nytte. Det er derfor viktig at pasienter med TIA henvises umiddelbart og helst direkte til det behandlende team, for å unngå forsinkelser. Forekomst av perioperative komplikasjoner må være lav.
Stentbehandling er en ny metode i rask utvikling. Effekten er så langt ikke dokumentert, og flest mulig pasienter bør inkluderes i de pågående randomiserte multisenterstudier.
Alle pasienter med carotisstenose skal, uavhengig av indikasjon for kirurgi, ha beste medisinske behandling. Dette inkluderer røykestopp, behandling med statin og platehemmer og god blodtrykkskontroll. Ved høygradige/multiple halskarstenoser advares det imidlertid mot aggressiv blodtrykkssenkning preoperativt.
Oppgitte interessekonflikter: Ingen
Hovedbudskap
-
Pasienter med carotisstenose og transitorisk iskemisk anfall (TIA), ikke- invalidiserende slag eller amaurosis fugax bør få medisinsk behandling, inkludert platehemmer og statin, og umiddelbart henvises til kirurgisk behandling
-
Slagforebyggende effekt ved kirurgisk behandling av carotisstenoser er dokumentert i flere store randomiserte, kontrollerte studier
-
Effekten av kirurgisk behandling er større ved symptomgivende enn ved asymptomatiske stenoser, større hos menn enn hos kvinner og øker med økende stenosegrad, og ved symptomgivende stenoser øker effekten med økende alder
-
Det foreligger ikke tilsvarende dokumentasjon for effekt av stentbehandling
- 1.
Bettermann K, Toole J. Diagnostic evaluation and medical management of patients with ischemic cerebrovascular disease. I: Rutherford RB, red. Vascular Surgery. 6. utg., 2. bd. Philadelphia: Elsevier, 2005: 1897 – 916.
- 2.
European Carotid Surgery Trialists’ Collaborative Group. MRC European Carotid Surgery Trial: interim results for symptomatic patients with severe (70 – 99 %) or with mild (0 – 29 %) carotid stenosis. Lancet 1991; 337: 1235 – 43.
- 3.
North American Symptomatic Carotid Endarterectomy Trial Collaborators. Beneficial effect of carotid endarterectomy in symptomatic patients with high-grade carotid stenosis. N Engl J Med 1991; 325: 445 – 53.
- 4.
European Carotid Surgery Trialists’ Collaborative Group. Randomised trial of endarterectomy for recently symptomatic carotid stenosis: final results of the MRC European Carotid Surgery Trial (ECST). Lancet 1998; 351: 1379 – 87.
- 5.
Barnett HJM, Taylor DW, Eliasziw M et al. The North American Symptomatic Carotid Endarterectomy Trial Collaborators. Benefit of carotid endarterectomy in patients with symptomatic moderate or severe stenosis. N Engl J Med 1998; 339: 1415 – 25.
- 6.
Cina CS, Clase CM, Haynes RB. Carotid endarterectomy for symptomatic carotid stenosis. Cochrane Database Syst Rev 1999: CD001081.
- 7.
Naylor AR. Does the modern concept of «best medical therapy» render carotid surgery obsolete? Eur J Vasc Endovasc Surg 2004; 28: 457 – 61.
- 8.
Executive Committee for the Asymptomatic Carotid Atherosclerosis Study. Endarterectomy for asymptomatic carotid artery stenosis. JAMA 1995; 273: 1421 – 8.
- 9.
MRC Asymptomatic Carotid Surgery Trial (ACST) Collaborative Group. Prevention of disabling and fatal strokes by successful carotid endarterectomy in patients without recent neurological symptoms: randomised controlled trial. Lancet 2004; 363: 1491 – 502.
- 10.
Heart Protection Study Collaborative Group. MRC/BHF Heart Protection Study of cholesterol lowering with simvastatin in 20536 high-risk individuals: a randomised placebo-controlled trial. Lancet 2002; 360: 7 – 22.
- 11.
Rothwell PM, Eliasziw M, Gutnikov SA et al. Carotid Endarterectomy Trialists Collaboration. Endarterectomy for symptomatic carotid stenosis in relation to clinical subgroups and timing of surgery. Lancet 2004; 363: 915 – 24.
- 12.
Rothwell PM, Warlow CP. Timing of TIAs preceding stroke: time window for prevention is very short. Neurology 2005; 64: 817 – 20.
- 13.
Salvesen R. Medikamentell sekundærprofylakse etter transitorisk cerebral iskemi eller hjerneinfarkt Tidsskr Nor Lægeforen 2003; 123: 2875 – 7.
- 14.
Antithrombotic Trialists" Collaboration. Collaborative meta-analysis of randomised trials of antiplatelet therapy for prevention of death, myocardial infarction, and stroke in high risk patients. BMJ 2002; 324: 71 – 86.
- 15.
PROGRESS Collaborative Group. Randomised trial of a perindopril-based blood-pressure-lowering regimen among 6105 individuals with previous stroke or transient ischaemic attack. Lancet 2001; 358: 1033 – 41.
- 16.
Grant EG, Benson CB, Moneta GL et al; Society of Radiologists in Ultrasound. Carotid artery stenosis: grayscale and Doppler ultrasound diagnosis – Society of Radiologists in Ultrasound Consensus Conference. Ultrasound Q 2003; 4: 190 – 8.
- 17.
Byrd S, Robless P, Baxter A et al. Carotid duplex ultrasonography: importance of standardisation. Asymptomatic Carotid Surgery Trial Collaborators and Vascular Laboratories. Int Angiol 1998; 17: 248 – 54.
- 18.
Rothwell PM, Gobson R, Warlow CP. Interrelation between plaque surface morphology and degree of stenosis on carotid angiograms and the risk of ischemic stroke in patients with symptomatic carotid stenosis. On behalf of the European Carotid Surgery Trialists’ Collaborative Group. Stroke 2000; 31: 615 – 21.
- 19.
Mathiesen EB. Risiko for hjerneslag ved carotisstenose – hvilken betydning har plakkmorfologi? Tidsskr Nor Lægeforen 2003; 123: 782 – 4.
- 20.
Pasientvolum og behandlingskvalitet. SMM-rapport nr. 2/2001. www.kunnskapssenteret.no/filer/Rapport2-01.pdf (20.10.2006).
- 21.
Birkmeyer JD, Stukel TA, Siewers AE et al. Surgeon volume and operative mortality in the United States. N Engl J Med 2003; 349: 2117 – 27.
- 22.
Norsk karkirurgisk register (NORKAR), årsrapport 2002. www.legeforeningen.no/assets/Carotis%202002.htm (20.10.2006).
- 23.
Dahl T, Rudjord K, Altreuther M et al. Data quality of surgery for carotid artery stenosis. Are the national vascular registries reliable? Eur J Vasc Endovasc Surg 2006; 31: 381 – 5.
- 24.
Krohg-Sørensen K, Lingaas PS, Solberg S et al. Behandling av kombinert carotisstenose og hjertesykdom Tidsskr Nor Lægeforen 2005; 125: 2017 – 20.
- 25.
Gottsäter A, Mätzsch T. Kirurgi snart även primärprevention vid slaganfall av höggradig karotisstenos. Läkartidningen 2004; 101: 1821 – 7.
- 26.
CAVATAS Investigators. Endovascular versus surgical treatment in patients with carotid stenosis in the Carotid and Vertebral Artery Transluminal Angioplasty Study (CAVATAS): a randomised trial. Lancet 2001; 357: 1729 – 37.
- 27.
Goodney PP, Schermerhorn ML, Powell RJ. Current status of carotid artery stenting. J Vasc Surg 2006; 43: 406 – 11.
- 28.
Yadav JS, Wholey MH, Kuntz RE et al for the Stenting and Angioplasty with Protection in Patients at High Risk for Endarterectomy Investigators. Protected carotid-artery stenting versus endarterectomy in high-risk patients. N Engl J Med 2004; 351: 1493 – 501.
- 29.
Dente K. Experts divided over carotid stenting for stroke prevention. Lancet Neurol 2006; 5: 24.
- 30.
The SPACE Collaborative Group. 30 day result from the SPACE trial of stent-protected angioplasty versus carotid endarterectomy in symptomatic patients: a randomised non-inferiority trial. Lancet 2006; 368: 1239 – 47.
- 31.
The international Carotid Stenting study website. www.cavatas.com (20.10. 2006).