En andregangsfødende kvinne i 30-årene ble hemodynamisk ustabil og utviklet sterke brystsmerter etter fødselen. Årsaken til symptomene viste seg å være en alvorlig komplikasjon ved vaginal fødsel etter et tidligere keisersnitt, men omfanget ble ikke avklart før over en uke senere.
Pasienten var en andregangsfødende kvinne med ukomplisert svangerskap, men var selektert til å føde ved kvinneklinikk grunnet tidligere keisersnitt. Etter eget ønske ble fødselen igangsatt i svangerskapsuke 41 + 3 med ballongkateter, og senere misoprostol 0,25 mg vaginalt uten at hun etablerte effektive rier. Amniotomi førte til at hun gikk i aktiv fødsel med rask og fin fremgang. Epidural var anlagt med mangelfull effekt. Etter under 30 minutters trykketid viste kardiotokograf (CTG) fosterasfyksi. Barnet ble derfor vakuumforløst med apgarskår på 7-8-9.
I Norge forsøker 75 % av kvinner med tidligere keisersnitt vaginal fødsel i neste svangerskap, med en vaginal fødselsrate på 63 % (1). Seleksjon til større sykehus skyldes risikoer som invasiv placenta og uterusruptur (1). For å unngå hyperstimulering og økt rupturrisiko ved induksjon etter keisersnitt, anbefales ballongkateter. Misoprostol og oksytocin kan brukes i lavere doser med kontinuerlig CTG-overvåkning under aktiv fødsel for å oppdage fosterstress eller for høy rieaktivitet (2).
Placenta kom spontant og var hel. Kvinnen var påfallende medtatt, men uten smerter. Det tilkom postpartumblødning fra uterusatoni. Initiale blodtrykk var 60/50, 84/44 og 93/57 mmHg, målt med 5–10 minutters mellomrom. Behandling med oksytocindrypp 50 E/500 ml intravenøst, 1 g traneksamsyre intravenøst, misoprostol 0,6 mg rektalt og en mindre mengde Ringer acetat ble gitt med god effekt. Vaginalrift og episiotomi ble suturert, og estimert blødningsmengde var 600–800 ml. 1,5 timer etter fødsel var blodtrykket 113/90 og pulsen var 120. Hun ble observert videre av jordmor på fødestue.
Postpartumblødning på mellom 500–1 000 ml forekommer hos 13–25 % av fødende i Europa (3), og skyldes oftest uterusatoni, rifter eller placentarester (4). Medikamentell behandling av postpartum blødning er lik for pasienter med og uten tidligere keisersnitt (5). Siden fødende kan være medtatte og oppleve blodtrykksfall etter atoniblødninger, ble tilstanden ikke oppfattet som alarmerende når tiltakene hadde effekt. Selv om oksytocin ikke regnes som en vasopressor, er det beslektet med vasopressin, som har vasopressorvirkning (6). Det antyder at oksytocin kunne hatt en midlertidig vasopressoreffekt.
2,5 timer postpartum utviklet pasienten sterke brystsmerter, nummenhet i venstre arm, kvalme og oppkast. Påtroppende gynekologisk forvakt ble tiltalt, og fant pasienten medtatt i sengen med øynene lukket. Hun svarte godt på spørsmål, og fremsto klar og orientert. Puls var 120–130 per minutt, blodtrykk varierte mellom 60/40 – 80/50 mmHg ved gjentatte målinger. Saturasjon var 98 % uten O2-tilskudd, og respirasjonsfrekvens var 26 per minutt. Det var ingen hereditet for hjerte- og karsykdom eller tromboembolisk sykdom, ingen magesmerter eller dyspné. Det ble startet 1 000 ml Ringer Acetat intravenøst, og bestilt blodprøver med tanke på koronariskemi og lungeemboli. Auskultasjon av hjerte og lunger var uten anmerkning. Hun var bløt og uøm ved palpasjon av abdomen, men anga litt ubehag ved dyp palpasjon i venstre fossa. Uterus sto like under umbilicus, og det var kun sparsom vaginalblødning. EKG viste normal sinusrytme, invertert T i avledning III, ST-depresjon på 1 mm i V3–V4. Gynekologisk bakvakt ble tilkalt.
Det ble klart for behandlingsteamet at pasienten var i sirkulatorisk sjokk. En rekke tilstander kan gi sirkulatorisk påvirkning og brystsmerter postpartum. EKG viste tegn til iskemi. Aktuelle differensialdiagnoser var iskemisk hjertesykdom, lungeemboli/fostervannsemboli, aortadisseksjon eller pågående blødning. I fravær av blødningsfokus ble ikke blodtransfusjon utført. Grunnet tidligere keisersnitt, ble uterusruptur vurdert, på tross av manglende magesmerter.
Pasienten viste kun delvis respons på intravenøs væske, med blodtrykk økende til 80/50 mmHg og pulsen forble høy. Anestesipersonell ble forsøkt tilkalt, men hadde på det tidspunktet ikke mulighet til å komme. Medisinsk vaktsjikt ble kontaktet med tanke på medisinske differensialdiagnoser. Alle samtalene om tilsyn og overflytting tok opp mot 40 minutter.
For å avklare diagnose og dermed videre behandling, ble CT abdomen/bekken og toraks rekvirert med tanke på aortadisseksjon, lungeemboli og uterusruptur. I samråd med radiolog begynte man med en serie CT abdomen/bekken uten intravenøs kontrast for å se etter abdominalblødning som ved uterusruptur.
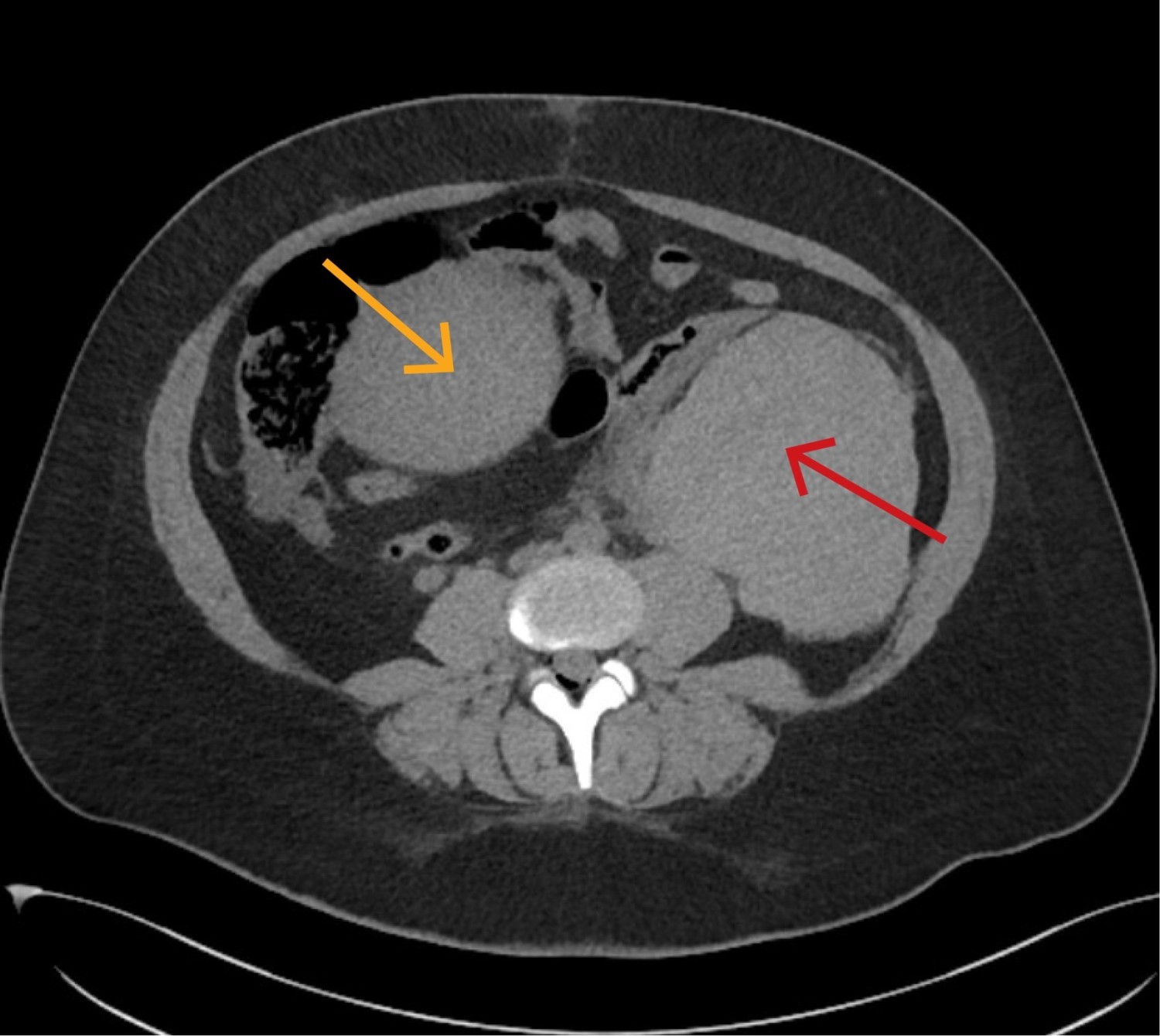
3,5 timer postpartum ble CT abdomen/bekken uten kontrast tatt, og radiolog beskrev et stort intraperitonealt hematom på venstre side av uterus (figur 1). Siden pasienten var sirkulatorisk ustabil, kjørte man rett på operasjon for innleggelse av sentralt venekateter, blodtransfusjon og kirurgisk intervensjon uten ytterligere bildediagnostikk.
Intravenøs narkose ble indusert raskt med ketamin 100 mg, propofol 50 mg, fentanyl 0,3 mg og rokuronium 100 mg for å redusere aspirasjonsrisiko og kardiodepressiv effekt. Blodprøver tatt tre timer etter fødsel, kom peroperativt og viste blant annet: Hemoglobin 9,7 g/dL (11,7–15,3), Troponin I hs 588 ng/L (< 45), kreatinin 96 µmol/L (45–90), Kalium 5,9 mmol/L (3,6–4,6), D-dimer 6,5 mg/L (< 0,5). Venøs blodgass: pH 7,30 (7,35–7,45), BE -6 mmol/L (-3–+3), pCO2 5,2 kPa (4,7–6,0), bikarbonat 19 mmol/L (21–27), laktat 5,8 mmol/L (0,5–2,2)
Teamet tolket blodprøvene som passende med type II hjerteinfarkt grunnet blødningssjokk, og blodgassen korrigert for venøse verdier som en moderat kompensert metabolsk laktacidose av samme årsak.
4,5 timer postpartum ble laparotomi utført via Pfannenstiel-snitt. Adheranser fra tidligere keisersnitt kompliserte inngrepet. Man fant rikelig med frisk blødning og koagler intraperitonealt, men noe mindre enn forventet fra radiologisk beskrivelse. En 6 cm totalruptur ble identifisert på uterus' høyre side i tidligere arr, og på venstre side forelå et truende rupturområde og flere defekter med pågående blødning (figur 2).
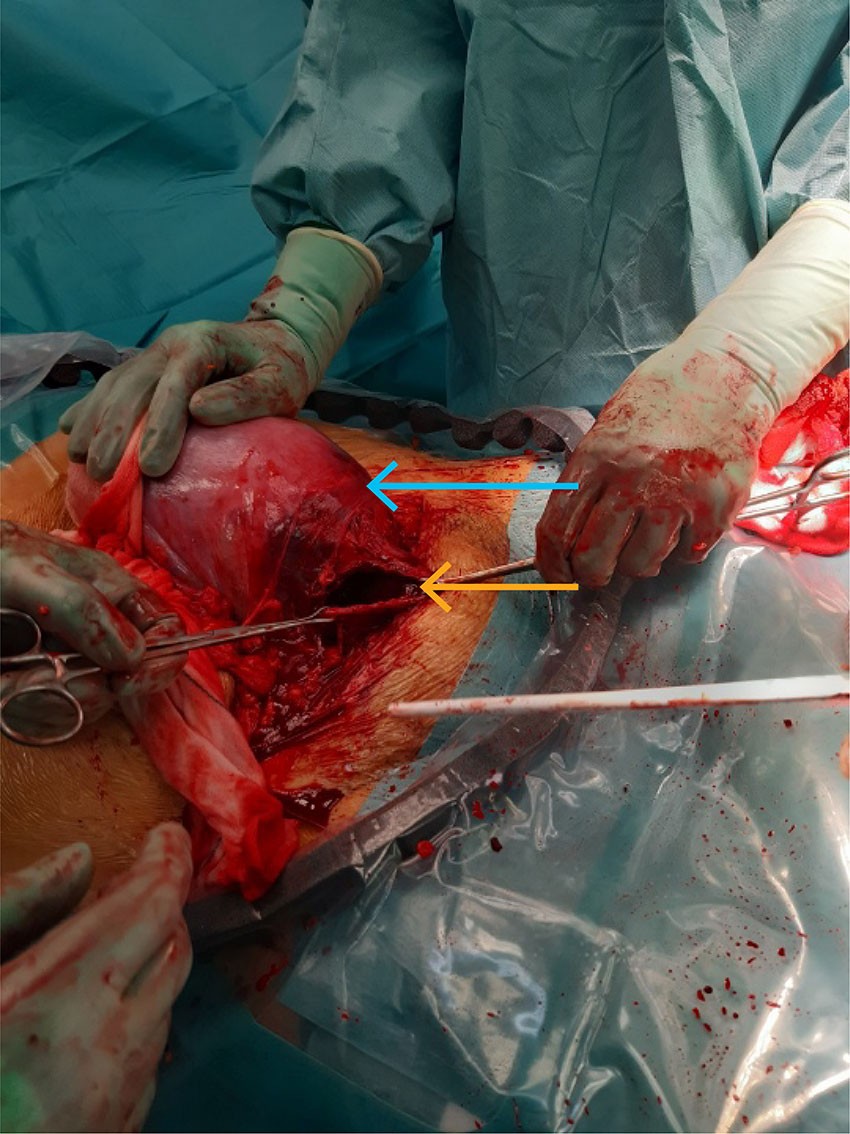
Uterusruptur forekommer i 0,2–1 % av fødsler etter et keisersnitt, og det øker til 2 % etter flere (2). Forekomsten er økende fordi flere fødende har kombinasjonen av tidligere keisersnitt og medikamentell riestimulering (7). Symptomer inkluderer konstante magesmerter, vaginalblødning, avtagende rier og endret fosterposisjon (8). Umiddelbart keisersnitt er nødvendig for å unngå perinatal død (2). Risikofaktorer omfatter tidligere uterusinngrep, stort barn, riestimulering, langvarig fødsel og vakuum/tangforløsning (8, 9). Pasienten fikk ingen riestimulerende medikamenter under aktiv fødsel, men hadde vakuumforløsning og smerter som kunne indikere ruptur, men smertene forsvant etter fødselen.
Pasienten ble stabilisert med transfusjoner, assistert av rotasjonstromboelastometri og arteriekranbaserte blodgassanalyser. Laveste Hb var 8,0 g/dL. Med en ekstra gynekolog ble komplett uterusruptur og truende rupturområde suturert. Hemostasefremmende matte ble plassert. Ved lukking var det ingen pågående blødning. Pasienten ble vekket fra narkose, men idet man fjernet operasjonsdekningen, så man at det var pågående vaginalblødning. Man fant ingen nye blødningsfokus ved spekuluminspeksjon på operasjonsstuen. Kompresser med traneksamsyre ble anlagt som tamponade vaginalt, og 50 E/500 ml intravenøst oksytocindrypp 150 ml/t ble anvendt for å fremme uteruskontraksjon, men pasienten blødde raskt gjennom kompressene.
Behandlingsteamet anså placentarester som mindre sannsynlig, og vurderte at risikoen for perforasjon av uterus ved utskrapning var høy. Pasienten lå fortsatt på operasjonsbordet, og det ble besluttet reoperasjon for å finne potensielle uterine blødningskilder som kunne forklare vaginalblødningen.
Under reoperasjonen ble sivblødning fra truende rupturområde på venstre side av uterus behandlet med suturer og hemostasefremmende matte og et venstresidig vakuumdren ble plassert. Total operasjonstid var 4,5 timer og ble avsluttet 9 timer etter fødselen, med et estimert blodtap på 4,5 liter. Pasienten fikk peroperativt intravenøst med 10 poser erytrocyttkonsentrat, 8 poser plasma, 3 pakker trombocyttkonsentrat, fibrinogen, kalsium, cefazolin 2 g som peroperativ antibiotikaprofylakse og humant immunglobulin mot Rh(D)-immunisering (Rhopylac) 300 μg grunnet RhD-negativ blodtype. Hun var deretter 20 timer på intensivavdelingen, hvor hun fikk 1 pose erytrocyttkonsentrat. Pasienten hadde stabile koagulasjonsprøver og ingen disseminert intravaskulær koagulasjon. Høyeste troponin var 1275 ng/L (< 45), men falt innen et døgn. Abdominaldrenet ble seponert etter to dager. Det var ingen vaginalblødning utover normal renselse. Hun ble etter eget ønske utskrevet på tredje postoperative dag, etter nye 2 poser erytrocyttkonsentrat og piperacillin-tazobactam 4 g × 3 intravenøst. Pasienten, med lang operasjonstid og forhøyet kroppsmasseindeks, fikk Fragmin 5000 E subkutant fra 20 timer postoperativt og i 14 dager. Oppfølging var planlagt hos fastlege og på kvinneklinikken.
Veileder for fødselshjelp tilrår tromboseprofylakse innen 6 timer etter hemostase og velkontrahert uterus ved alvorlig postpartumblødning grunnet økt koagulasjonsaktivitet, infeksjonsrisiko og immobilisering (5).
Åtte dager postpartum begynte pasienten plutselig å blø rikelig vaginalt. Ambulansepersonell mistenkte alvorlig blødning med estimert mengde på 2–3 L, og bestilte kriseblod. Blodtrykk lå mellom 56/34 og 101/66 mmHg, og puls var 135 per minutt. Hun ble oppfattet som hemodynamisk ustabil, og grunnet værforhold ble hun fløyet til et universitetssykehus med luftambulansehelikopter istedenfor til fødesykehuset. Under transporten var pasienten våken, og blodtrykket ble målt fire ganger til rundt 110/70 mmHg, pulsen gradvis fallende til 126 per minutt. Det ble gitt en pose RhD-positivt blod, en pakke LyoPlas (frysetørret plasma), og traneksamsyre 2 g intravenøst. Hun ble møtt av kirurgisk mottaksteam på universitetssykehuset. Det var normalt blodtrykk, puls 108 per minutt og ingen pågående vaginalblødning. Ultralyd abdomen viste ingen fri væske. CT avdekket et stort retroperitonealt hematom med mistenkt aktiv blødning og et mindre hematom i cervix/vagina (figur 3). Bildene fra fødselsinnleggelsen ble gransket på nytt, og man så for første gang at hematomet som var beskrevet som intraperitonealt ved fødesykehuset, også da hovedsakelig lå retroperitonealt.
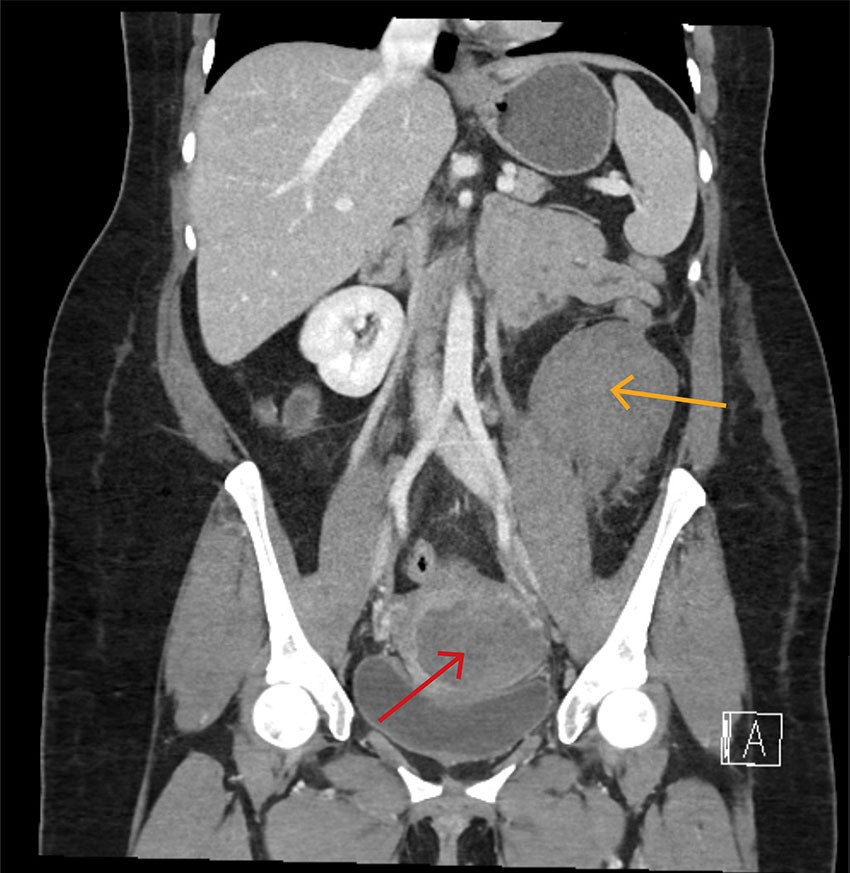
Siden pasienten var blitt operert ved et annet sykehus, hadde man ikke full oversikt over tidligere sykehistorie, og behandlingsteamet trodde en stund at det retroperitoneale hematomet var nytilkommet. Sammen med radiologisk mistanke om pågående blødning i hematomet, førte dette til at man utførte akutt laparotomi, selv om pasienten hadde stabile parametre.
En ekstra gynekolog ble tilkalt, og pasienten ble operert med Pfannenstiel-snitt og midtlinjesnitt. Ny radiologisk vurdering av CT bilder like etter operasjonsstart, avkreftet mistanke om aktiv blødning. Det ble ikke funnet blødning intraperitonealt, men et eldre retroperitonealt hematom på venstre side tilsvarende 600 ml som ble evakuert. Uterus var subkontrahert og det ble gitt oksytocininfusjon 50 E/500 ml intravenøst. Forsiktig utskrapning av uteruskaviteten avdekket en sparsom mengde hinnerester.
Undersøkelser ved universitetssykehuset avkreftet ny pågående blødning, noe som var overraskende gitt de alvorlige observasjonene i ambulansejournalen. I ettertid har behandlende leger tenkt at vaginalblødningen som oppstod i pasientens hjem, kan ha vært tømming av et gammelt væsketilblandet hematom, eventuelt frisk blødning etter skorpeløsning fra sårflate i uterus, som ble ekstra kraftig grunnet subkontrahert uterus med gjenværende fosterhinner. Tromboseprofylaksen kunne ha medvirket til vedvarende sivblødning og vaginal uttømming av et gammelt hematom etter hjemkomst. Akuttmedisinsk kommunikasjonssentral sitt estimat på 2–3 liter blod kan ha inkludert blodfortynnet væske. Det kliniske bildet med forbigående hypotensjon og normalt til høyt blodtrykk, stress og høy puls kan ha vært uttrykk for en vekslende vasovagal reaksjon og sympatikusaktivering, og det tydet ikke på en stor pågående blødning. Selv om vi ikke har opplysninger som skulle tilsi at det var deler av det gamle retroperitoneale hematomet som tømte seg spontant vaginalt i dette tilfellet, er nettopp dette beskrevet hos tre kvinner i en kasuistikkserie fra 2022 (10).
Pasienten reiste hjem elleve dager postoperativt med tromboseprofylakse i form av Fragmin 7500 E i 4 uker. Hun var RhD-negativ og hadde fått én pose RhD-positivt blod prehospitalt. Immunhematologiske undersøkelser viste tilstedeværelse av RhD-positive erytrocytter i pasientens blod, og det ble gitt Rhophylac 3000 μg intravenøst. Kontroll av RhD-immunisering ble planlagt etter tre og seks måneder.
Diskusjon
Pasienter som blir hemodynamisk ustabile etter fødsel, krever en bred tilnærming og hurtig håndtering for best mulig utfall. Blødning er en viktig årsak til hypotensjon og takykardi postpartum, og bør alltid mistenkes. Som vår sykehistorie viser, kan det i praksis være vanskelig å identifisere kvinnene som har større blødning enn normalt. Leger og sykepleiere må være forberedt på å prioritere fødende i sirkulatorisk sjokk.
Vår pasient hadde alvorlige symptomer som kunne stamme fra flere organsystemer. En bred tilnærming var derfor viktig for å finne riktig diagnose. En intensivseng er på sitt beste en perfekt plass for et slikt kollokvium. Det viste seg at pasienten hadde blødningssjokk forårsaket av uterusruptur med både uvanlig presentasjon og lokalisasjon av påfølgende hematom. Sammen med en initial tolkning av hematomet som intraperitonealt bidro dette til å forsinke diagnosen. CT ble først protokollert og utført uten intravenøs kontrast, noe som riktignok påviste blødning, men som vanskeliggjorde vurdering av lokalisasjon og omfang av dette. Påfølgende serier med intravenøs kontrast ble ikke gjort da pasienten ble oppfattet som sirkulatorisk ustabil og tatt rett til operasjon. Som hovedregel bør pasienter som man mistenker har pågående blødning eller sirkulatorisk sjokk, få utført flerfaset CT med intravenøs kontrast, med eller uten «tomserie».
Ved første inngrep trodde behandlingsteamet at man hadde funnet forklarende årsak på pasientens tilstand med uterusruptur og intraperitonealt hematom med pågående blødning. Det viste seg imidlertid at det også forelå et stort retroperitonealt hematom. Dette forklarer at mengden koagler ved primærinngrepet ble oppfattet som noe mindre enn forventet, og at pasienten hadde et stort transfusjonsbehov. Retroperitoneale hematomer er primært en radiologisk diagnose, og vil ikke kunne avdekkes ved intraperitoneal laparotomi via Pfannenstiel-snitt (11). Dette understreker viktigheten av å lete videre dersom kart og terreng ikke passer helt. Misoppfattelsen av hematomets beliggenhet ved fødesykehuset og antagelsen om en pågående blødning ved universitetssykehuset, kan ha ført til en unødvendig ekstra laparotomi. På universitetssykehuset ble kirurgisk mottaksteam aktivert på grunn av ambulansepersonellets bekymringsfulle observasjoner. Med mange involverte i et hektisk miljø, er alle innstilt på å sikre rask og effektiv behandling, som ofte er kirurgi. I en slik kontekst kan det være utfordrende å stoppe opp og bruke den tiden som trengs for å konstatere at pasientens tilstand likevel ikke krever det.
Behandlingsvalg for retroperitoneale hematomer baserer seg på hematomets lokalisasjon, hemodynamisk stabilitet og hvorvidt man mistenker pågående blødning. Stabile pasienter uten aktiv blødning, kan ofte behandles konservativt. Ved mistanke om aktiv blødning hos stabile pasienter, er angiografi med stenting eller embolisering et alternativ (12). Ustabile pasienter med aktiv blødning krever oftest kirurgi (12, 13). På fødesykehuset var kirurgi nødvendig for å stabilisere pasienten og reparere uterusdefekter, noe som gjorde angiografi med stenting/embolisering overflødig.
Mange av riene, spesielt de jeg kjente på fremsiden av magen, var så kraftige og smertefulle at det flere ganger kjentes ut som at alt skulle revne innvendig. På en av de siste pressriene etter at vakuumet var satt, kjente jeg at noe skjedde mens jeg presset, og jeg fikk en ny type smerte på høyre side av magen. Etter fødselen følte jeg meg utrolig slapp, kvalm, svimmel og hadde ingen krefter.
Som pasientkasustikken viser, er det slik at den i ettertid perfekte tilnærmingen i praksis ofte ikke gjøres. Vi ønsker å fremheve tre hovedlæringspunkter fra pasientforløpet. Det er viktig å være bevisst på at retroperitoneale hematomer kan oppstå hos fødende (11). Ved uterusruptur kan blod dissekere seg opp langs ligamentum latum og videre inn i retroperitoneum, og gi blødningssjokk uten større forutgående symptomer (13, 14). Et annet læringspunkt er at det kan være utfordrende radiologisk å skille mellom intra- og retroperitonealt hematom, og å avklare om det er billedmessige tegn til pågående blødning. Dette fordrer ekstra årvåkenhet fra kirurger når radiologiske og kliniske funn ikke helt samsvarer. Om enn mindre unikt, er det siste læringspunktet viktigheten av god kommunikasjon og samhandling i den akuttmedisinske kjeden for å sikre rask og god behandling.
Tusen takk til Torgrim Lysen Skiaker og Trine Skjeflo for å ha bidratt med radiologiske refleksjoner i arbeidet med manuskriptet.
Pasienten har gitt samtykke til at artikkelen og bilder blir publisert.
Artikkelen er fagfellevurdert.
- 1.
Lehmann S, Baghestan E, Børdahl PE et al. Low risk pregnancies after a cesarean section: Determinants of trial of labor and its failure. PLoS One 2020; 15: e0226894. [PubMed][CrossRef]
- 2.
Norsk gynekologisk forening. Uterusruptur. https://www.legeforeningen.no/foreningsledd/fagmed/norsk-gynekologisk-forening/veiledere/veileder-i-fodselshjelp/uterusruptur/ Lest 24.3.2024.
- 3.
Calvert C, Thomas SL, Ronsmans C et al. Identifying regional variation in the prevalence of postpartum haemorrhage: a systematic review and meta-analysis. PLoS One 2012; 7: e41114. [PubMed][CrossRef]
- 4.
Al-Zirqi I, Vangen S, Forsen L et al. Prevalence and risk factors of severe obstetric haemorrhage. BJOG 2008; 115: 1265–72. [PubMed][CrossRef]
- 5.
Norsk gynekologisk forening. Postpartum blødning (PPB). https://www.legeforeningen.no/foreningsledd/fagmed/norsk-gynekologisk-forening/veiledere/veileder-i-fodselshjelp/postpartum-blodning/ Lest 22.3.2024.
- 6.
Baribeau DA, Anagnostou E. Oxytocin and vasopressin: linking pituitary neuropeptides and their receptors to social neurocircuits. Front Neurosci 2015; 9: 335. [PubMed][CrossRef]
- 7.
Al-Zirqi I, Stray-Pedersen B, Forsén L et al. Uterine rupture: trends over 40 years. BJOG 2016; 123: 780–7. [PubMed][CrossRef]
- 8.
Al-Zirqi I, Stray-Pedersen B, Forsén L et al. Uterine rupture after previous caesarean section. BJOG 2010; 117: 809–20. [PubMed][CrossRef]
- 9.
Kaczmarczyk M, Sparén P, Terry P et al. Risk factors for uterine rupture and neonatal consequences of uterine rupture: a population-based study of successive pregnancies in Sweden. BJOG 2007; 114: 1208–14. [PubMed][CrossRef]
- 10.
Redondo Villatoro A, Azcona Sutil L, Vargas Gálvez D et al. Diagnosis and Management of Postpartum Retroperitoneal Hematoma: A Report of 3 Cases. Am J Case Rep 2022; 23: e935787. [PubMed][CrossRef]
- 11.
Mondie C, Maguire NJ, Rentea RM. Retroperitoneal Hematoma. https://www.ncbi.nlm.nih.gov/books/NBK558928/ Lest 22.3.2024.
- 12.
Chan YC, Morales JP, Reidy JF et al. Management of spontaneous and iatrogenic retroperitoneal haemorrhage: conservative management, endovascular intervention or open surgery? Int J Clin Pract 2008; 62: 1604–13. [PubMed][CrossRef]
- 13.
Rafi J, Khalil H. Maternal morbidity and mortality associated with retroperitoneal haematomas in pregnancy. JRSM Open 2018; 9: 2054270417746059. [PubMed][CrossRef]
- 14.
Maroyi R, Ngeleza N, Kalunga K et al. Large retroperitoneal hematoma following vaginal delivery: a case report. J Med Case Rep 2021; 15: 290. [PubMed][CrossRef]
Vi vil takke Vikan et al for en interessant kasuistikk, «En kvinne i 30-årene med brystsmerter og sirkulatorisk sjokk etter fødsel», nylig publisert i Tidsskriftet (1). Kasuistikken tar opp sentrale utfordringer ved postpartumblødning (PPH). Vi ønsker å dele våre erfaringer med bruk av aortaballong som et blødningskontrollerende tiltak, nemlig Resuscitative Endovascular Balloon Occlusion of the Aorta (REBOA). I høyinntektsland, som Norge, har man sett at insidensen av PPH øker (2). Dette illustrerer behovet for å utforske nye metoder for tidlig kontroll av alvorlig PPH. REBOA er et ballongkateter som via arteria femoralis føres retrograd opp aorta og inflateres for å få blødningskontroll. Dette kan bidra til blødningskontroll og stabilisering av situasjonen (3). Ved St. Olavs hospital i Trondheim tilkalles intervensjonsradiolog for REBOA-innleggelse, men prosedyren kan også gjennomføres av annet personell med kompetanse i ultralydbruk og Seldingerteknikk. Anestesileger vil kunne være en relevant gruppe på sykehus uten intervensjonsradiolog (3, 4). Bruk av REBOA er tatt inn i retningslinjene til Norsk Gynekologisk Forening, og har vært i bruk ved St. Olavs hospital siden 2008, både profylaktisk i situasjoner med forventet blødningsfare, og ved akutte blødninger. I 2024 publiserte vi våre erfaringer gjennom 14 år (3). Hovedfunnene var bedring i systolisk blodtrykk innen fem minutter etter oppblåst ballong, lavere forbruk av blodprodukter og tendens til færre hysterektomier som blødningskontrollerende tiltak. Vi observerte ingen alvorlige tromboemboliske hendelser, som er en tidligere velrapportert komplikasjon.
Vikan et al beskriver en langvarig primæroperasjon (4,5 timer), og med massiv transfusjon av blodprodukter. I situasjoner med manglende blødningskontroll og et uoversiktlig operasjonsfelt vil en midlertidig og intermitterende okklusjon av infrarenale aorta kunne gi kirurger ro til å identifisere blødningsfokus og oppnå hemostase. Det vil også kunne gi anestesipersonellet anledning til å transfundere pasienten og reversere blødningssjokket på et tidligere tidspunkt, og således bidra til å redusere risiko for komplikasjoner (5).
Litteratur
1. Vikan IMN, Skogøy K, Klausen SS et al. En kvinne i 30-årene med brystsmerter og sirkulatorisk sjokk etter fødsel. Tidsskr Nor Legeforen 2024; 144. doi: 10.4045/tidsskr.23.0774
2. Mentzoni CT, Klungsøyr K, Engjom HM. Trends in severe postpartum haemorrhage among nulliparous women with spontaneous onset of labour: A population-based cohort study. BJOG 2024. doi: 10.1111/1471-0528.17838.
3. Stensaeth KH, Carlsen MIS, Løvvik TS et al. Resuscitative endovascular balloon occlusion of the aorta (REBOA) as adjunct treatment in life threatening postpartum hemorrhage: Fourteen years' experience from a single Norwegian center. Acta Obstet Gynecol Scand 2024; 103: 965-969.
4. Brede JR, Lafrenz T, Klepstad P et al. Feasibility of Pre-Hospital Resuscitative Endovascular Balloon Occlusion of the Aorta in Non-Traumatic Out-of-Hospital Cardiac Arrest. J Am Heart Assoc 2019; 8(22): e014394.
5. Brede JR, Søvik E, Rehn M. Resuscitative endovascular balloon occlusion of the aorta: the postpartum haemorrhage perspective. Crit Care 2022; 26: 57.