En mann i 40-årene med økende funksjonsdyspné tok kontakt med fastlege. Han fikk påvist alvorlig anemi, og denne viste seg å ha en sjelden årsaksforklaring. Utredningen illustrerer den diagnostiske tankegangen ved nyoppdaget anemi samt viktigheten av representative vevsprøver.
Pasienten var en mann i midten av 40-årene med overvekt, hypertensjon som var velbehandlet med angiotensin II-reseptorantagonist, og alvorlig søvnapné som han brukte nattlig kontinuerlig luftveisstøtte (CPAP) for. Et par måneder før det aktuelle hadde han fått drenert en abdominal hudabscess, og i den forbindelse blitt behandlet med dikloksacillin. Ellers hadde han ikke startet med noen nye medisiner eller vært utsatt for nylig erkjent infeksjonssykdom.
Grunnet økende funksjonsdyspné og fatigue av én måneds varighet tok han kontakt med fastlege. Initiale blodprøver viste grav anemi, med hemoglobin (Hb) på 5,4 g/dL (referanseområde 13,4–17,0). Han hadde ingen tidligere kjent anemi, og blodprøver fra tre år tidligere viste Hb 16,8 g/dL. Han ble innlagt ved lokalsykehus for transfusjon og videre utredning. Ved klinisk undersøkelse i mottak var pasienten takykard med regelmessig sinusrytme på 118 slag/min og ellers afebril med normale vitale parametere og normal organstatus.
Utvidede blodprøver ved innkomst viste makrocytose med middel erytrocyttvolum (mean corpuscular volume MCV) på 107 fL (82–98) og bilineær cytopeni med lett leukopeni 2,4 × 109/L (4,1–9,8 × 109/L) og retikulocytopeni 0,023 × 1012/L (0,03–0,10 × 1012/L) samt normalt trombocyttantall 269 × 109/L (145–348 × 109/L). Videre fant man kobalamin 244 pmol/L (350–700), folat 15,1 nmol/L (> 10,0), metylmalonsyre 0,14 μmol/L (> 0,2), homocystein 13,6 μmol/L (> 14,2), laktatdehydrogenase (LD) 255 U/L (105–205), haptoglobin 1,19 g/L (1,8–4,0), bilirubin 12 μmol/L (< 20), C-reaktivt protein (CRP) 2 mg/L (< 5), kreatinin 69 μmol/L (60–106) og alaninaminotransferanse (ALAT) 142 U/L (10–70). Blodutstryk viste anisocytose og enkelte hypersegmenterte granulocytter, uten sikker blastøkning, mens man ved forsøk på beinmargsaspirat ikke fikk representativt materiale.
Ved hemolyse vil haptoglobin raskt bli ikke-detekterbar, og dette sammenholdt med kun lett forhøyet LD og normal bilirubin gjorde det lite sannsynlig at det forelå noe signifikant hemolyse. Selv om en B12-mangel ikke kunne forklare hele det aktuelle bildet, ble det startet peroral substitusjonsbehandling med B12-vitaminpreparat for mistenkt begynnende mangeltilstand.
Anemi klassifiseres ut fra lav, normal og høy MCV, som henholdsvis mikrocytær, normocytær og makrocytær anemi. For praktiske formål vil man i primærhelsetjenesten gjerne foretrekke å måle gjennomsnittsinnholdet av hemoglobin i de røde blodcellene (MCH), da denne parameteren ikke øker med tiden etter prøvetaking, slik MCV gjør i løpet av få timer (1). Basert på denne inndelingen kan man ofte få en diagnostisk pekepinn som kan bidra i den videre utredningen. Forslag til slik utredning, assosierte blodprøvefunn og vanlige årsaker til hver av disse kategoriene er oppsummert i figur 1. Man må være oppmerksom på at flere tilstander kan foreligge samtidig og påvirke MCV i ulike retninger, for eksempel ved samtidig jern- og vitamin B12-mangel, som kan resultere i normocytær anemi (2).
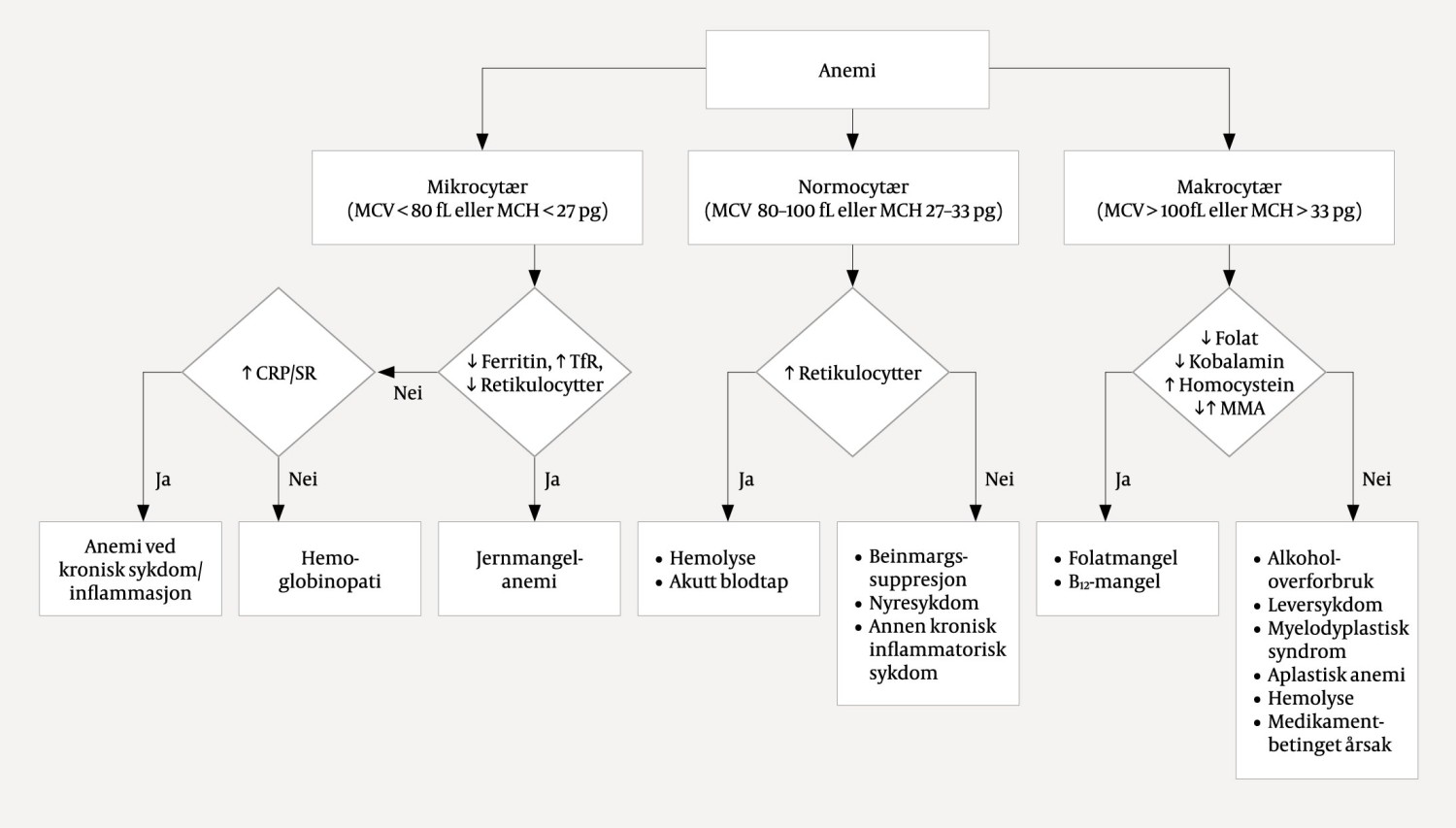
Patofysiologien ved en makrocytær anemi forårsaket av folat og/eller vitamin B12-mangel kan forklares ved at begge vitaminene er viktige i nukleinsyremetabolismen, og ved mangel oppstår det følgelig redusert DNA-syntese og celledeling. Lave konsentrasjoner av kobalamin er et tidlig tegn på vitamin B12-mangel, mens metylmalonsyre og homocystein vil stige senere i forløpet, da disse i større grad reflekterer intracellulære forhold og om det foreligger en funksjonell mangel (3). Det gjorde det altså ikke i vårt tilfelle.
Hemolyse er et velkjent fenomen som kan inntreffe ved alvorlig vitamin B12-mangel. Den er forårsaket av både intra- og ekstramedullær destruksjon av umodne, kjerneholdige og dysplastiske erytrocytter. Vitamin B12-mangel er også en viktig differensialdiagnose ved pancytopeni (4–6).
Pasienten rapporterte ingen gastrointestinale symptomer, og malabsorpsjonsutredning ble utført uten serologiske holdepunkter for cøliaki eller annen gastroenterologisk sykdom. Nyrefunksjonsparametrene var normale, men serummåling viste sterkt forhøyet erytropoietin, 2 628 IE/L (4,3–29,0), som forventet ved en kompensatorisk tilstand grunnet hypoksemi ved alvorlig anemi (7). Løselig transferrinreseptor ble målt til 1,3 mg/L (1,8–4,0), og man påviste hyperferritinemi, 3 105 μg/L (34–300), med forhøyet transferrinmetning 88 % (15–57 %).
Som ledd i videre malignitetsutredning ble det utført serum- og urin-proteinelektroforese, uten funn av monoklonalt immunglobulin. CT helkropp med kontrast viste splenomegali, 15,2 cm i lengste diameter, uten øvrig aktuell patologi. Pasienten var inneliggende i totalt tre døgn for transfusjoner og prøvetaking før han ble skrevet ut til hjemmet, med avtale om videre poliklinisk oppfølging.
Løselig transferrinreseptor er en nyttig markør ved utredning av de patofysiologiske mekanismene ved en nyoppdaget anemi (8). Proteinet produseres i hovedsak av erytroide forstadier og er derfor en kvantitativ markør som i stor grad gjenspeiler erytropoietisk aktivitet. Konsentrasjonen vil være redusert ved nedsatt eller fraværende erytropoese og forhøyet ved en ineffektiv eller stimulert erytropoese, som for eksempel ved jernmangel eller hemolyse. Den er også en tidlig indikator på respons under oppstart av behandling, mens endring i hemoglobin ennå ikke kan forventes (9).
Ferritin er et lagringsprotein for jern og derfor en indirekte markør for kroppens jernlagre. Lave verdier er assosiert med jernmangel, mens hyperferritinemi er et uspesifikt funn, ettersom ferritin også er et akuttfaseprotein. Hyperferritinemi hos vokse vil i kun 10 % av tilfellene skyldes et reelt jernoverskudd. Hos den resterende andelen sees det heller i relasjon til reaktive prosesser som blant annet infeksjoner, alkoholoverforbruk, fedme, malignitet, autoimmune tilstander og leversykdom (8). Transferrinmetning er et mål på hvor stor andel av jernbindingsseter på transportproteinet transferrin som er okkupert. Følgelig vil det ved reaktiv hyperferritinemi hovedsakelig være fravær av forhøyet transferrinmetning. Hyperferritinemi med forhøyet transferrinmetning, typisk > 45 % hos kvinner og > 50 % hos menn, taler ofte for et reelt jernoverskudd (10, 11). Til slutt kan tilstander som hematologisk malignitet og aplastisk anemi være assosiert med økt transferrinmetning, ettersom jernet i disse tilfellene ikke inkorporeres i en normal erytropoese i beinmargen.
På bakgrunn av funnene ble det utført genotyping med tanke på arvelig hemokromatose. C282Y-heterozygoti ble påvist, noe som ikke kunne forklare transferrinmetning av slik karakter. Fosfatidyletanol (PEth), som er en svært spesifikk markør for alkoholinntak, ble målt til 0,06 μmol/L. Dette er forenlig med et moderat alkoholkonsum de siste 2–4 ukene før prøvetaking (12). Nyoppstått anemi kan være første tegn ved både hematologisk eller annen solid malignitet.
Pasienten rapporterte ingen B-symptomer i form av feber, nattesvette eller vekttap. Han hadde ikke opplevd avføringsendring, og Hemo-Fec-undersøkelse var negativ. Imidlertid hadde han familiær opphopning av tykk- og endetarmskreft. Selv om det ikke var sterke biokjemiske eller kliniske holdepunkter for gastrointestinal patologi, valgte man å utføre poliklinisk koloskopi for å utelukke åpenbar patologi som medvirkende årsak til den uttalte anemien. Ingen slik patologi ble funnet.
Pasienten hadde i påvente av videre utredning et transfusjonsbehov på rundt to erytrocyttkonsentrater per uke og var fullt sykmeldt i denne perioden. Beinmargsbiopsi tatt tidligere i forløpet var av suboptimal teknisk kvalitet og beskrevet som bestående av periost og fragmentert beinmarg, med mulige områder med hypercellulær beinmarg og fibrose. Det ble derfor gjort utvidede blodprøver med tanke på myeloproliferativ neoplasi. Verken JAK2-, CALR- eller MPL-mutasjon ble påvist.
Myelofibrose skyldes klonal proliferasjon av stamceller som produserer ulike cytokiner og vekstfaktorer. Dette medfører progressiv fibrose, hvorpå det gjennom ekstramedullær myelopoese i milten oppstår økende splenomegali, som er et av kjennetegnene ved denne sykdommen. Mutasjon i JAK2-genet sees hos omtrent 50–60 % av pasienter med myelofibrose (13). Til sammenligning sees varianter av MPL- og CALR-genene hos henholdsvis 10 % og 25–30 % av denne pasientpopulasjonen (14). Diagnosekriteriene ved myeloproliferative neoplasier baseres i stor grad på funn av disse somatiske mutasjonene (15), i tillegg til typiske blodprøvemønster og morfologiske funn ved beinmargsbiopsi (16, 17).
Biopsisvar ga initialt mistanke om myelofibrose, men det histopatologiske bildet passet ikke med pasientens perifere blodverdier: relativt lavt LD-nivå, fravær av leukocytose og trombocytopeni samt fravær av relevante somatiske mutasjoner. Man valgte derfor å gjenta de diagnostiske beinmargsundersøkelsene tre uker etter den initiale biopsitakingen. Ny biopsi var teknisk vellykket og viste en hypercellulær beinmarg med betydelig redusert og venstreforskjøvet erytropoese (figur 2). Spesialfarging for retikulin viste områder med lett økning av fibre, svarende til grad 1, og det forelå dermed ingen signifikant fibrose. Det var flere lymfoide infiltrat bestående av morfologisk upåfallende lymfoide celler, og immunhistokjemisk farging for CD3 og CD20 viste blanding av T- og B-celler. Immunfarging viste også økt forekomst av T-celler og i mindre grad B-celler utenom infiltratene, tolket som reaktive T-lymfoide infiltrat. PCR-analyse med henblikk på rearrangering av T-cellereseptorer viste en oligoklonal profil med noen klonale ekspansjoner. Flowcytometrisk immunfenotyping av beinmargsaspirat viste ingen klonale B-celler eller populasjoner med immunfenotype som ved T-celleleukemier. Disse undersøkelsene ga dermed ikke holdepunkt for en klonal lymfoproliferativ tilstand.
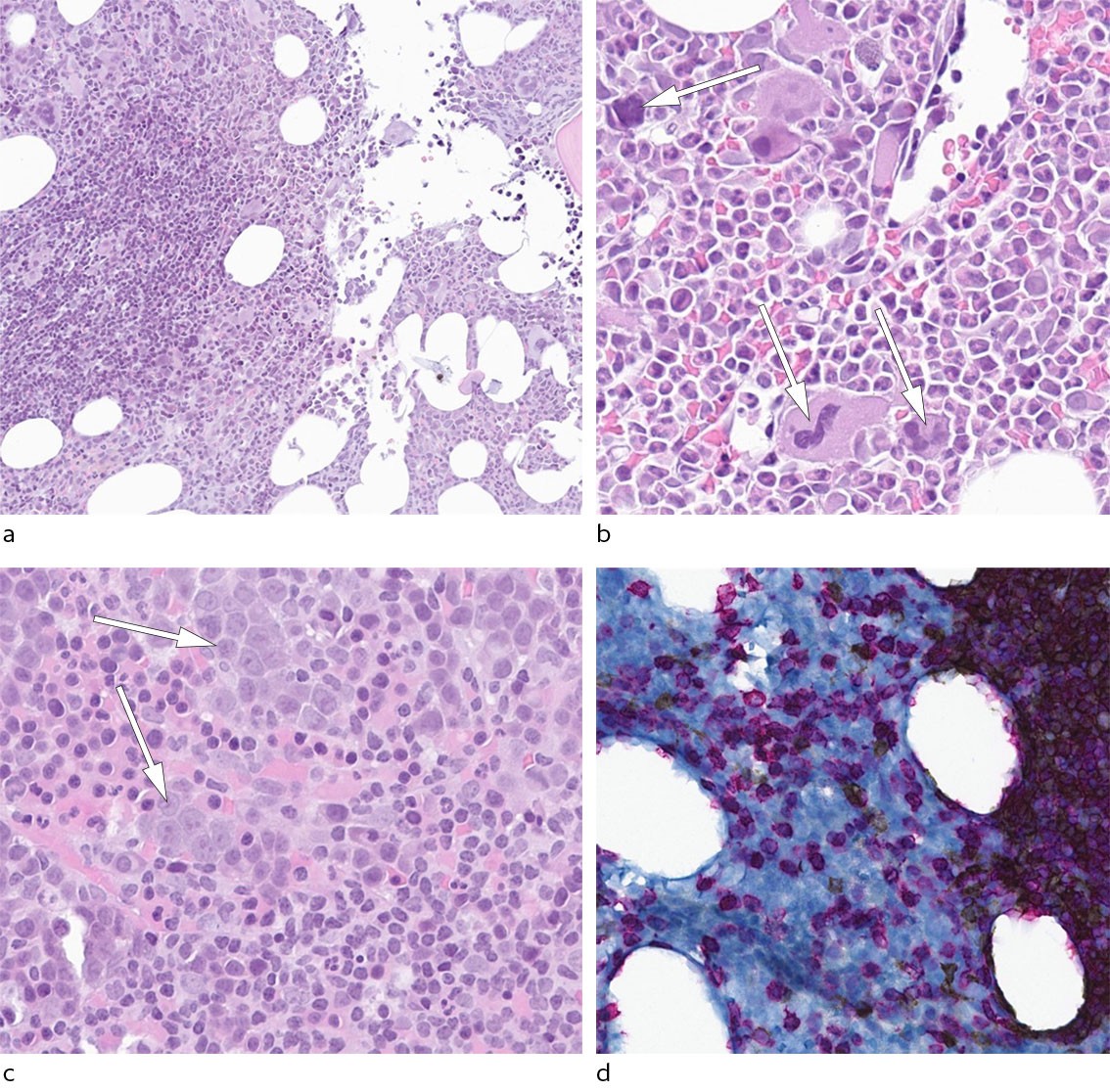
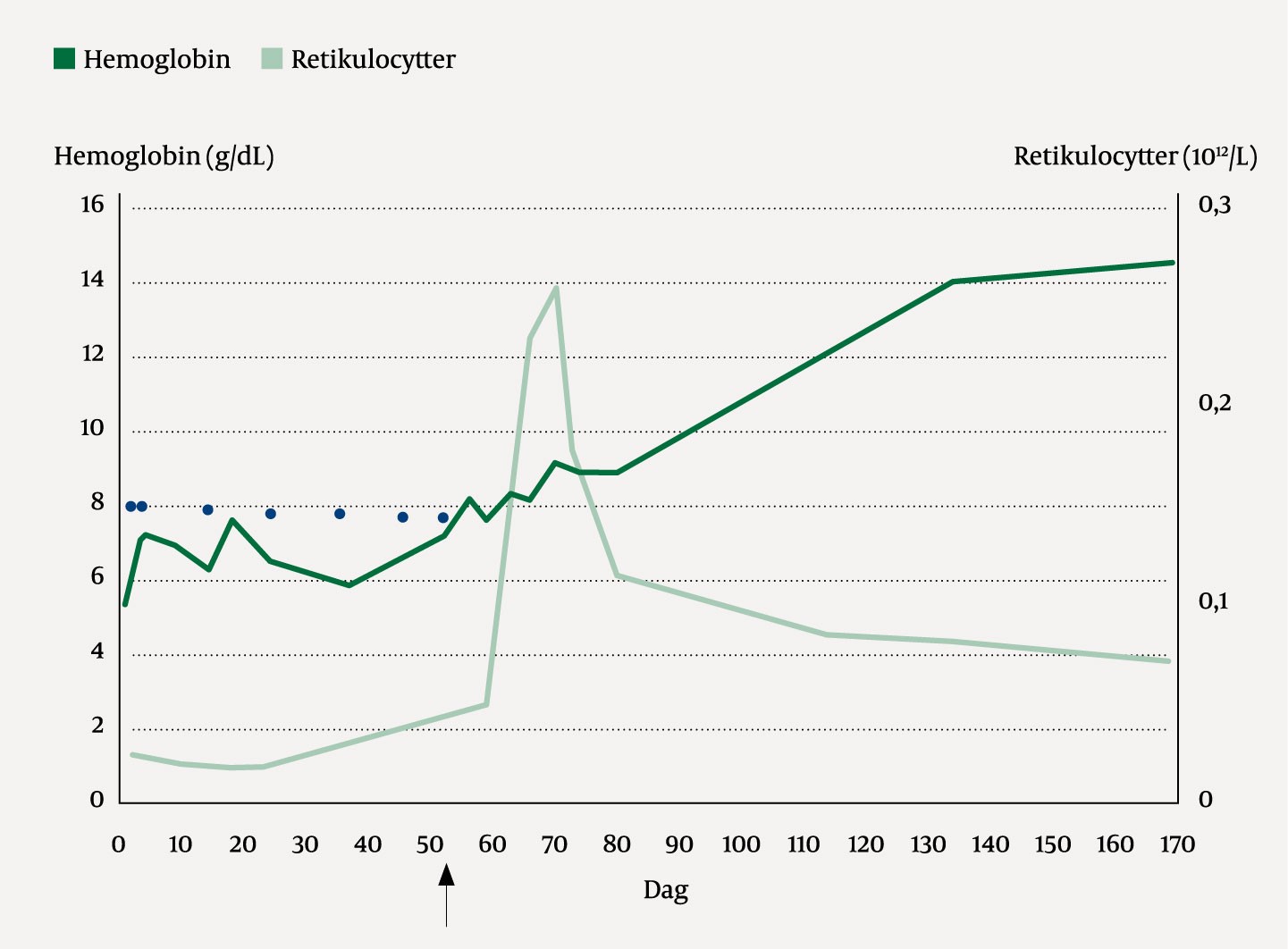
Basert på den tilnærmet fraværende erytropoesen sammen med et ellers reaktivt preget margbilde, og sammenholdt med annen bred diagnostikk uten holdepunkter for lymfom, tymom eller annen bakenforliggende årsak, kunne man nå sette diagnosen idiopatisk ervervet erytroaplasi (pure red cell aplasi, PRCA). Immunsuppressiv behandling i form av ciklosporin med initial dosering 6 mg/kg daglig ble igangsatt. Den første måneden ble pasienten fulgt relativt tett med ukentlige blodprøver og telefonisk kontakt ved vår avdeling. Forholdsvis raskt hadde pasienten økende retikulocytter, leukocytter, transferrinreseptor og etter hvert også stigende verdier og normalisering av hemoglobin (figur 3). Ciklosporindosen ble opprettholdt til hemoglobinverdien var normalisert, etterfulgt av en forsiktig, kontrollert nedtrapping.
Diskusjon
Den aktuelle kasuistikken illustrerer de diagnostiske overveielsene som inngår i en anemiutredning og viktigheten av representativ prøvetaking for å stille riktig diagnose. Funn av økt fibrose og økt antall lett dysmorfe megakaryocytter i den primære beinmargsbiopsien ble vurdert til å kunne være forenlig med en myeloproliferativ neoplasi. Feiltolkningen kan forklares med suboptimal biopsitaking, der man har truffet tangentielt på periost, og at det var mangelfulle kliniske opplysninger.
Ved anemiutredning kommer man ofte langt med vurdering av basale blodprøver. Noen ganger vil diagnostikken kreve mer omfattende utredning med vurdering av sjeldne tilstander. Erytroaplasi er et slikt sjeldent syndrom, klassifisert som enten genetisk, idiopatisk eller sekundært til annen underliggende sykdom eller ytre faktor (ramme 1).
Primær/genetisk erytroaplasi
Diamond-Blackfan-anemi
Ervervet erytroaplasi
Idiopatisk/primær erytroaplasi (autoimmun)
Sekundær erytroaplasi
Annen autoimmun tilstand
Immunologisk mediert AB0-uforlikelig stamcelletransplantat
Lymfoproliferativ neoplasi
Annen hematologisk malignitet
Solide tumorer
Tymom
Infeksjon
Medikamentutløst årsak
Graviditetsutløst årsak
Insidensen i den voksne befolkningen er antatt å være omtrent én per én million per år, og forekommer noe hyppigere hos kvinner (18). Hos barn kan man se et lignende bilde gjerne etter infeksiøse tilstander. Særlig synes parvovirus B19 å være assosiert med tilstanden.
Tilstanden karakteriseres ved normocytær til makrocytær anemi og skyldes produksjonssvikt som kommer til uttrykk som retikulocytopeni samt svært nedsatt eller fraværende erytropoese. Erytroaplasi bør mistenkes ved nyoppstått isolert anemi med samtidig alvorlig retikulocytopeni. Diagnostikken baseres på beinmargsundersøkelser, som viser tilnærmet eller fullstendig fravær av erytroblaster i en ellers normalt utseende beinmarg.
I utgangspunktet skal det være isolert avvik i den røde linjen. Assosierte avvik i øvrige linjer kan derimot også foreligge ved erytroaplasi, som i det aktuelle tilfellet med en ikke-signifikant leukopeni. Generell inflammasjon og aktivering av spesielt T-lymfocytter, som påvist i økt mengde hos vår pasient, synes å ha en sentral rolle i patogenesen ved erytroaplasi. Det kan også forklare en mindre påvirkning av andre cellelinjer, som hos vår pasient. Ervervet idiopatisk erytroaplasi regnes som autoimmun og er forårsaket av differensieringsarrest av erytroide celler, med utvikling av alvorlig retikulocytopeni og anemi etter hvert. Man vil typisk se en kompensatorisk stigning i erytropoietin som ikke resulterer i hemoglobinøkning, da erytropoesen er sterkt nedsatt eller fraværende.
Medikamenter og toksiner er rapport å kunne utløse erytroaplasi (ramme 1). Både antimikrobielle midler og immunmodulerende midler, i tillegg til rekombinert framstilt erytropoietin, er beskrevet å kunne gi erytroaplasi (19). Vår pasient hadde i forkant av det aktuelle fått behandling med dikloksacillin, og gitt den kronologiske tidssammenhengen kan vi ikke utelukke at det var en assosiasjon mellom den medikamentelle behandlingen og utvikling av en sekundær ervervet erytroaplasi. En grundig medikamentanamnese er derfor viktig i slike tilfeller. Hvorvidt det i den aktuelle kasusen dreide seg om en idiopatisk eller sekundær ervervet erytroaplasi, er dermed vanskelig å konkludere med. Under kritisk informasjon i hans journal er det derfor notert at man i framtiden bør utvise stor forsiktighet med å skrive ut et legemiddel i samme medikamentklasse som dikloksacillin.
Behandlingen ved ervervet erytroaplasi retter seg mot eventuelle underliggende tilstander (ramme 1). Dersom tilstanden vurderes som idiopatisk, vil behandlingen bestå av immunsuppressiver. Ettersom T-lymfocytter synes sentrale i patogenesen, er immunsuppressiver med T-cellehemmende effekt, som ciklosporin, ofte førstevalg (20). Responsrater på > 75 % er rapportert, og ciklosporin kan kombineres med eller erstattes av prednisolon ved manglende eller suboptimal effekt. Etter remisjon med normalisering av hemoglobinverdier kan ciklosporin trappes sakte ned, men vedlikeholdsbehandling kan bli nødvendig (21).
Anemi er en vanlig problemstilling som norske leger møter, og det er essensielt med riktig prøvetaking for videre diagnostikk. En sjelden gang vil en uvanlig tilstand være det bakenforliggende. Denne kasuistikken minner om viktigheten av at patolog og kliniker kommuniserer rundt vurdering av prøvematerialet og eventuelt får gjentatt prøvetakingen for å få det kliniske bildet til å henge sammen med diagnostiske beslutninger.
Pasienten har gitt samtykke til at artikkelen blir publisert.
Artikkelen er fagfellevurdert.
- 1.
Wu DW, Li YM, Wang F. How Long can we Store Blood Samples: A Systematic Review and Meta-Analysis. EBioMedicine 2017; 24: 277–85. [PubMed][CrossRef]
- 2.
Tefferi A. Anemia in adults: a contemporary approach to diagnosis. Mayo Clin Proc 2003; 78: 1274–80. [PubMed][CrossRef]
- 3.
Hannibal L, Lysne V, Bjørke-Monsen AL et al. Biomarkers and Algorithms for the Diagnosis of Vitamin B12 Deficiency. Front Mol Biosci 2016; 3: 27. [PubMed][CrossRef]
- 4.
Koury MJ, Ponka P. New insights into erythropoiesis: the roles of folate, vitamin B12, and iron. Annu Rev Nutr 2004; 24: 105–31. [PubMed][CrossRef]
- 5.
Wu Q, Liu J, Xu X et al. Mechanism of megaloblastic anemia combined with hemolysis. Bioengineered 2021; 12: 6703–12. [PubMed][CrossRef]
- 6.
Weinzierl EP, Arber DA. The differential diagnosis and bone marrow evaluation of new-onset pancytopenia. Am J Clin Pathol 2013; 139: 9–29. [PubMed][CrossRef]
- 7.
Suresh S, Rajvanshi PK, Noguchi CT. The Many Facets of Erythropoietin Physiologic and Metabolic Response. Front Physiol 2020; 10: 1534. [PubMed][CrossRef]
- 8.
Hagve TA, Lilleholt K, Svendsen M. Jernmangelanemi–tolking av biokjemiske og hematologiske funn. Tidsskr Nor Legeforen 2013; 133: 161–4. [PubMed][CrossRef]
- 9.
Beguin Y. Soluble transferrin receptor for the evaluation of erythropoiesis and iron status. Clin Chim Acta 2003; 329: 9–22. [PubMed][CrossRef]
- 10.
Fleming RE, Ponka P. Iron overload in human disease. N Engl J Med 2012; 366: 348–59. [PubMed][CrossRef]
- 11.
Sandnes M, Ulvik RJ, Vorland M et al. Hyperferritinemia-A Clinical Overview. J Clin Med 2021; 10: 2008. [PubMed][CrossRef]
- 12.
Aakerøy R, Skråstad RB, Helland A et al. Nye markører for påvisning av alkoholbruk. Tidsskr Nor Legeforen 2016; 136: 1643–7. [PubMed][CrossRef]
- 13.
Almedal H, Vorland M, Aarsand AK et al. Myeloproliferative neoplasiar og JAK2-mutasjonar. Tidsskr Nor Legeforen 2016; 136: 1889–94. [PubMed][CrossRef]
- 14.
Klampfl T, Gisslinger H, Harutyunyan AS et al. Somatic mutations of calreticulin in myeloproliferative neoplasms. N Engl J Med 2013; 369: 2379–90. [PubMed][CrossRef]
- 15.
Arber DA, Orazi A, Hasserjian R et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia. Blood 2016; 127: 2391–405. [PubMed][CrossRef]
- 16.
Alvarez-Larrán A, López-Guerra M, Rozman M et al. Genomic characterization in triple-negative primary myelofibrosis and other myeloid neoplasms with bone marrow fibrosis. Ann Hematol 2019; 98: 2319–28. [PubMed][CrossRef]
- 17.
Tefferi A, Lasho TL, Finke CM et al. CALR vs JAK2 vs MPL-mutated or triple-negative myelofibrosis: clinical, cytogenetic and molecular comparisons. Leukemia 2014; 28: 1472–7. [PubMed][CrossRef]
- 18.
Nakazawa H, Sakai K, Ohta A et al. Incidence of acquired pure red cell aplasia: a nationwide epidemiologic analysis with 2 registry databases in Japan. Blood Adv 2022; 6: 6282–90. [PubMed][CrossRef]
- 19.
Means RT. Pure red cell aplasia. Blood 2016; 128: 2504–9. [PubMed][CrossRef]
- 20.
Gurnari C, Maciejewski JP. How I manage acquired pure red cell aplasia in adults. Blood 2021; 137: 2001–9. [PubMed][CrossRef]
- 21.
Means RT. Pure red cell aplasia. Hematology (Am Soc Hematol Educ Program) 2016; 2016: 51–6. [PubMed][CrossRef]