Det snakkes i dag om en epidemi av type 2-diabetes. Nye tall fra Nord-Trøndelag viser en økning i prevalens av diabetes hos menn fra 2,6 % til 3,3 % bare i løpet av de ti siste årene (1). Prevalensen av overvekt (kroppsmasseindeks> 30 kg/m 2 ) økte i samme tidsperiode fra 7,5 % til 14 % hos menn og fra 13 % til 18 % hos kvinner som ikke har diabetes. Disse tallene gjør at vi forventer en enda sterkere økning av type 2-diabetes i årene som kommer. Det forventes en tredobling av prevalensen i Asia, dobling i Amerika og økning fra 3,5 % til 4,7 % i Europa i løpet av de kommende 25 år (2). Diabetespasienter koster samfunnet tre ganger så mye som gjennomsnittspopulasjonen (3). Det er derfor viktig å kunne iverksette en effektiv primærprevensjon av type 2-diabetes.
Type 2-diabetes karakteriseres av perifer insulinresistens og en defekt i β -cellenes evne til å produsere eller sekrere insulin (4). Type 2-diabetes utgjør ca. 80 % av all diabetes i Norge (1). Sent debuterende autoimmun diabetes (late autoimmune diabetes in the adult, LADA), eller den autosomalt dominant arvelige (maturity onset diabetes in the young, MODY), en type 2-diabetes som debuterer før fylte 25 år, holdes utenfor begrepet type 2-diabetes i denne artikkelen.
I det følgende vil jeg gjøre rede for risikofaktorer for type 2-diabetes og epidemiologiske studier om slike risikofaktorer. De største prospektive studier på primærprevensjon av type 2-diabetes omtales og muligheten for primærprevensjon av type 2-diabetes diskuteres.
Risikofaktorer for type 2-diabetes
Hvilke miljøfaktorer, genetiske faktorer, kombinasjoner av miljø og genetikk og biokjemiske faktorer øker risikoen for utvikling av sykdommen?
Overvekt
Kroppsmasseindeks mellom 25 kg/m 2 og 30 kg/m 2 regnes som overvekt og større eller lik 30 kg/m 2 som fedme. Ved overvekt økes behovet for insulin, noe som etter mange års overvekt kan utløse en β -celledefekt. I en amerikansk studie hvor 51 000 helsearbeidere deltok, var overvekt ved 21 års alder og vektøkning gjennom ungdommen viktige risikofaktorer for utvikling av type 2-diabetes (5). Menn med en kroppsmasseindeks større eller lik 35 kg/m 2 hadde en relativ risiko for utvikling av diabetes på 42 sammenliknet med menn med kroppsmasseindeks lavere enn 23 kg/m 2 . Mage-hofte-ratio og magediameter er også assosiert med økt risiko for type 2-diabetes (6). Erfaringer fra studier på pimaindianere i USA viser at det tar 15 – 20 år før økningen i kroppsvekt fører til type 2-diabetes og ytterligere 5 – 15 år før de vaskulære komplikasjonene kommer for fullt.
Redusert fysisk aktivitet
Fysisk aktivitet øker både det insulinmedierte og det ikke-insulinmedierte glukoseopptaket i minst 24 timer. Insulinsensitiviteten i muskel- og fettvev øker fordi antallet og aktiviteten til glukosetransportøren GLUT 4 øker ved fysisk aktivitet (7).
Man har funnet en signifikant sammenheng mellom insidens av diabetes og antall ganger i uken man driver fysisk aktivitet nok til at man svetter (8). En prospektiv studie av 21 000 amerikanske, mannlige leger viste en relativ risiko for diabetes på 0,64 hos dem som trimmet minst en gang i uken sammenliknet med dem som mosjonerte sjeldnere. Lavest var risikoen hos dem som trimmet fem eller flere ganger i uken, med en relativ risiko på 0,58 i løpet av fem års oppfølging (8). Den største forskjellen i risiko i denne studien var altså mellom de fysisk inaktive og de som drev lett fysisk aktivitet. Liknende resultater er funnet hos kvinner (9). Nylig viser data fra en tilsvarende undersøkelse av kvinnelige sykepleiere at det er like effektivt å gå som å jogge for å forebygge diabetes hvis energiforbruket er like stort (10). I USA anbefaler man en halv time rask gange fem (helst sju) dager i uken.
Kombinasjonen av overvekt og en sedat livsførsel øker risikoen for diabetes slik det ble funnet i en amerikansk studie med 5 990 menn fulgt i 14 år (11). For hver økning i kaloriforbruk på 2 100 kJ/uke ble risikoen for diabetes redusert med 6 %. Den beskyttende effekten av fysisk aktivitet var mest uttalt hos høyrisikoindivider (høy kroppsmasseindeks og/eller førstegradsslektning med diabetes) (11, 12).
Ifølge den såkalte Barkerhypotesen er ugunstige ernæringsforhold i fosterstadiet med påfølgende lav fødselsvekt en risikofaktor både for hjerte- og karsykdommer og for type 2-diabetes i voksen alder (13).
Tabell 1
Risikofaktorer for utvikling av type 2-diabetes
| Overvekt |
| Fysisk inaktivitet |
| Diabetes i familien |
| Alder |
| Nedsatt glukosetoleranse |
| Nedsatt insulinrespons |
| Røyking |
| Hyperinsulinemi |
| Hypertensjon |
| Hypertriglyseridemi |
| Lavt HDL-nivå |
| Beskyttende faktor |
| Moderat alkoholforbruk |
Røyking
Menn som røykte 25 sigaretter daglig eller mer hadde en relativ risiko på 1,94 for å utvikle type 2-diabetes i løpet av seks år sammenliknet med ikke-røykere i den amerikanske helsepersonellundersøkelsen (14). Den britiske regionale hjertestudien har vist at røyking var assosiert med en 50 % økning i risiko for type 2-diabetes (15).
Genetiske faktorer
En person som har en førstegradsslektning med type 2-diabetes har en livstidsrisiko på ca. 40 % for å utvikle sykdommen. Konkordansraten blant eneggede tvillinger er ca. 90 %. Man vet i dag ikke hvilke gener som er involvert. Det finnes heller ingen genetisk markør som er assosiert med en økt risiko for sykdomsutvikling.
I Nord-Trøndelags-undersøkelsen var prevalensen av type 2-diabetes 3,2 % for alle aldersgrupper samlet, og ca. 10 % for personer over 70 år (1).
Kombinasjon genetikk og miljø
Blant noen etniske grupper som de amerikanske pimaindianerne, folk på stillehavsøya Nauru og urinnvånerne i Australia er prevalensen av diabetes ekstremt høy, opp mot 50 %. Dette kan skyldes faktorer knyttet til en svært rask overgang til en vestlig livsstil.
Biokjemiske faktorer
Et nedsatt insulinsvar på glukosestimulering er et tegn på β -celledysfunksjon. Et forhøyet fastende insulinnivå, målt som fastende C-peptid> 1 000 pmol/l, er tegn på insulinresistens. I en stor studie fra Uppsala hvor 1 860 middelaldrende menn ble fulgt i ti år, viste det seg at fastende insulinnivå og akutt insulinrespons på intravenøst tilført glukose predikerte utvikling av type 2-diabetes (16).
Med nedsatt glukosetoleranse mener man en metabolsk tilstand som ligger mellom en normal glukosehomøostase og manifest diabetes. Ca. 30 % av dem med nedsatt glukosetoleranse vil senere utvikle diabetes (6). Nedsatt glukosetoleranse defineres av WHO som et fastende plasma-glukose under 7,0 mmol/l og plasma-glukose større eller lik 7,8 mmol/l og lavere enn 11,1 mmol/l to timer etter en peroral glukosetoleransetest (inntak av 75 g glukose løst i 250 ml vann) (17).
Hypertriglyseridemi, lavt HDL-nivå, hypertensjon og hjerte- og karsydom er også risikofaktorer for type 2-diabetes (15, 16).
Er alkohol en beskyttende faktor?
Den store helseundersøkelsen av over 20 000 mannlige, amerikanske leger har nylig vist en negativ lineær sammenheng mellom lett (en drink/uke) til moderat (>en drink/dag) alkoholforbruk og utvikling av type 2-diabetes i løpet av 12 år (18). Liknende resultater er funnet i den amerikanske helsepersonellundersøkelsen hvor menn som drakk 30 – 49,9 g alkohol daglig, hadde en relativ risiko på 0,61 for å utvikle type 2-diabetes i løpet av seks år sammenliknet med dem som var avholdende (14). Videre har en prospektiv britisk studie med 7 700 menn i alderen 40 – 59 år vist at risikoen for å utvikle type 2-diabetes er lavest hos dem som drikker 16 – 42 enheter alkohol per uke sammenliknet med dem som drakk mindre enn en enhet per uke (15).
Hjelper det å påvirke risikofaktorene?
Diett og fysisk aktivitet
Det er gjort svært få prospektive studier med et formål å redusere risikofaktorene for type 2-diabetes. I to studier har man intervenert med diett og økt fysisk aktivitet hos personer med nedsatt glukosetoleranse. I en kinesisk studie ble 577 personer med nedsatt glukosetoleranse grupperandomisert til diett, økt fysisk aktivitet eller begge deler. Studien varte i seks år. De som fikk aktiv behandling (diett, fysisk aktivitet eller begge deler), hadde en diabetesinsidens på 43 % sammenliknet med 68 % i kontrollgruppen (19), en statistisk signifikant forskjell.
En undersøkelse fra Malmö viste at 181 menn med nedsatt glukosetoleranse som drev fysisk aktivitet (gange, jogging, fotball eller badminton minst en time i uken), og som fikk råd om diett i ett år, hadde en relativ risiko for å utvikle diabetes i løpet av seks år på 0,37 sammenliknet med kontrollgruppen. Denne studien var imidlertid ikke randomisert. I Oslo-studien ble 219 høyrisikoindivider randomisert til fysisk aktivitet tre ganger i uken med en intensitet på 60 – 80 % av maksimal hjertefrekvens. En annen gruppe fikk individuell kostholdsveiledning sammen med ektefelle tre ganger. En tredje gruppe fikk både kostveiledning og råd om fysisk aktivitet. Fastende glukose- og insulinverdier ble redusert i den kombinerte gruppen sammenliknet med en kontrollgruppe (20).
Tabell 2
Primærprevensjon av type 2-diabetes, pågående studier
| Intervensjon | Deltakere | Design | Varighet (år) | Avsluttes | Navn |
| 7 % vektreduksjon og øke fysisk aktivitet 2 940 kJ/uke eller metformin | 3 000 med nedsatt glukosetoleranse | Randomisert, prospektiv | 4,5 | 2002 | Diabetes Prevention Programme |
| Orlistat | 3 305 overvektige, 21 % med nedsatt glukosetoleranse | Randomisert, prospektiv, placebokontrollert | 4 | Desember 2001 | XENDOS |
| Acarbose | 1 200 med nedsatt glukosetoleranse | Randomisert, prospektiv, placebokontrollert | 4 | 2002 | STOP NIDDM |
| Livsstilsinter- vensjon | 523 overvektige med nedsatt glukosetoleranse | Randomisert, prospektiv | 6 | 2004 | Diabetes Prevention Study in Finland |
Farmakologisk intervensjon
Det finnes i dag ikke medikamenter som er vist å forebygge type 2-diabetes. Metformin øker insulinsensitiviteten uten å forårsake hypoglykemi. Metformin er derfor potensielt et medikament for bruk til å forebygge diabetes (21). En liten studie fra Sverige har vist god effekt av et sulfonylurea (tolbutamid) på forebygging av diabetes hos personer med nedsatt glukosetoleranse når tolbutamid ble gitt sammen med restriksjon av raskt resorberbare karbohydrater (22). Sulfonylurea har imidlertid aldri blitt testet ut i store og randomiserte studier.
Tiazolidindioner er en medikamentgruppe som øker insulinsensitiviteten. I en liten amerikansk studie fikk 18 overvektige pasienter pasienter troglitazon. Ni av disse hadde nedsatt glukosetoleranse. Troglitazonbehandling mer enn doblet insulinsensitiviteten hos denne gruppen (23). I en stor prospektiv studie hvor troglitazon ble brukt i primærprevensjon av type 2-diabetes, utviklet en pasient leversvikt og døde (24). Utprøvninger av troglitazon i primærprevensjon av type 2-diabetes er derfor stoppet. Det arbeides nå intenst med å finne andre glitazoner som ikke kan gi leverskade. Disse testes nå ut hos pasienter som har utviklet diabetes.
Orlistat er en pancreaslipasehemmer som hemmer absorpsjonen av fett i dietten med ca. 30 %. I to studier har overvektige pasienter fått orlistat sammen med anbefaling om 20 % reduksjon i kaloriinntak. Food and Drug Administration i USA (FDA) har analysert ettårsresultatene av disse studiene. De viser at to tredeler av de overvektige som fikk orlistat, klarte å gå ned 5 % i vekt. I placebogruppen var det bare en tredel som oppnådde samme vektreduksjon (25). Det er nylig publisert en studie hvor man har lagt sammen resultatene fra tre forskjellige randomiserte multisenterstudier med 20 måneders varighet. Deltakerne var 675 overvektige (kroppsmasseindeks 30 – 43 kg/m 2 ) personer. Den aktive behandlingen var orlistat 120 mg tre ganger daglig sammen med en lavenergidiett. I behandlingsgruppen hadde 19 % nedsatt glukosetoleranse ved starten av studien. Av disse var det signifikant flere som fikk normalisert sitt glukosenivå (72 %) sammenliknet med placebogruppen (49 %) (26). Etter to år hadde den orlistat- og diettbehandlede gruppen et vekttap som var 3 kg (signifikant) større enn placebogruppen. Det var også en tendens til mindre type 2-diabetes i intervensjonsgruppen.
Primærprevensjon av type 2-diabetes, pågående studier
I løpet av et par år vil vi få resultatene av store, prospektive og randomiserte studier med primærprevensjon av type 2-diabetes som hovedmål. En amerikansk studie med 3 000 deltakere, alle med nedsatt glukosetoleranse i øvre 50 %-percentilen, har tre armer:
-
– Livsstilsintervensjon med det mål å redusere vekten med 7 % (massiv kursing og oppfølging) og øke fysisk aktivitet med 2 940 kJ per uke (sykle eller gå 30 minutter minst fem ganger i uken).
-
– Metformin og standard livsstilsintervensjon
-
– Placebo og standard livsstilsintervensjon
Gjennomsnittlig observasjonstid er 4,5 år. Studien avsluttes i 2002 og vil kunne gi svar på om livsstilsintervensjon og/eller metformin kan forebygge type 2-diabetes.
I en studie med 1 200 pasienter med nedsatt glukosetoleranse testes effekten av acarbose, en α -glukosidase-hemmer, versus placebo. Acarbose forsinker fordøyelsen av karbohydrater med følgende lavere postprandialt insulin- og glukosenivå (27). Gjennomsnittlig oppfølgingstid er fire år.
I en finsk studie er 523 overvektige personer med nedsatt glukosetoleranse randomisert til to grupper (28):
-
– Livsstilsintervensjon. Sju konsultasjoner med klinisk ernæringsfysiolog første året, deretter hvert kvartal, i tillegg til individuell veiledning i fysisk aktivitet
-
– Standard livsstilsintervensjon
I en interimrapport etter ett år hadde intervensjonsgruppen et signifikant vekttap på 4,7 kg mot 0,9 kg i kontrollgruppen. Fastende plasma-glukosenivå var også signifikant lavere i intervensjonsgruppen (5,9 mmol/l versus 6,4 mmol/l) (28). Studien pågår i seks år og forventes avsluttet i 2004.
I en svensk studie deltar 3 305 overvektige pasienter (kroppsmasseindeks større eller lik 30 kg/m 2 ) hvorav 21 % med nedsatt glukosetoleranse. Intervensjonsgruppen får pancreaslipasehemmeren orlistat og diett mens kontrollgruppen får bare diett. Observasjonstiden er fire år. Studien er beregnet avsluttet i desember 2001 (29) (tab 2).
Hyperglykemi
Det er et spørsmål om vi bør gå inn for å forebygge hyperglykemi. Det kan være like viktig å behandle risikofaktorer mot hjerte- og karsykdom som å forebygge diabetes hos personer med nedsatt glukosetoleranse. Risikofaktorene overlapper i stor grad. Det er derfor viktig å behandle dyslipidemi og hypertensjon og også redusere røyking. Forebygging av type 2-diabetes alene forebygger ikke nødvendigvis makrovaskulær sykdom (30) selv om Malmö-studien viser en normalisering av mortaliteten etter 12 år hos personer med nedsatt glukosetoleranse som fikk diett og livsstilsintervensjon (31).
Skal man drive screening eller undersøke høyrisikoindivider for å forebygge type 2-diabetes? Et forslag er å screene alle over 45 år hvert 3 – 5 år og de med risikofaktorer årlig (32). Personer med nedsatt glukosetoleranse må identifiseres da de har høy risiko for både type 2-diabetes og hjerte- og karsykdom. Det er i denne gruppen effekten av livsstilsintervensjon og eventuelt farmakologisk intervensjon er størst.
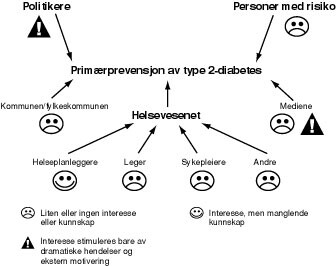
Det finnes mange barrierer mot livsstilsintervensjon hvor individualisering av livsstilprogrammer og opprettholdelse av forandringer over tid kanskje er de viktigste. Figur 1 viser hvilke krefter man har å kjempe mot i forebygging av type 2-diabetes (33). Med innføring av fastlegeordningen vil det kanskje lønne seg å gi en refusjon fra Rikstrygdeverket hvis man oppnår en vektreduksjon på 7 %, og videre en årlig refusjon for å opprettholde den lavere vekten. Tilsvarende kan det tenkes innført en refusjon for å hindre økning i blodsukkernivå ved peroral glukosetoleransetest hos personer med nedsatt glukosetoleranse.
Konklusjon
Det er klare indikasjoner på at økt fysisk aktivitet og et anbefalt kosthold kan forebygge type 2-diabetes. Om tre år vil resultatene av den amerikanske studien om forebygging av type 2-diabetes foreligge. Den har potensial til å kunne et endelig svar på dette spørsmålet. Om forebygging med medikamenter som metformin og orlistat er effektivt, vil også kunne bli avklart. Utfordringen blir å utvikle metoder for å gjennomføre livsstilsintervensjon i praksis.
- 1.
Midthjell K, Krüger O, Holmen J, Tverdal A, Claudi T, Bjørndal A et al. Rapid changes in the prevalence of obesity and known diabetes in an adult Norwegian population – The Nord-Trøndelag Health Surveys: 1984 – 1986 and 1995 – 1997. Diabetes Care 1999; 22: 1813 – 20.
- 2.
Williams R. Breaking the barriers for improved glycaemic control: primary care and secondary care interface. Diabet Med 1998; 15 (suppl 4): 37 – 40.
- 3.
Kangas T, Aro S, Koivisto VA, Salinto M, Laakso M, Reunanen A. Structure and costs of health care of diabetic patients in Finland. Diabetes Care 1996; 19: 494 – 7.
- 4.
Beck-Nielsen H, Groop LC. Metabolic and genetic characterization of prediabetic states. Sequence of events leading to non-insulin-dependent diabetes mellitus. J Clin Invest 1994; 94: 1714 – 21.
- 5.
Chan JM, Rimm EB, Colditz GA, Stampfer MJ, Willett WC. Obesity, fat distribution, and weight gain as risk factors for clinical diabetes in men. Diabetes Care 1994; 17: 961 – 2.
- 6.
Edelstein SL, Knowler WC, Bain RP, Barrett-Connor E, Dowse GK, Haffner SM et al. Predictors of progression from impaired glucose tolerance to NIDDM. Diabetes 1997; 46: 701 – 10.
- 7.
Goodyear LJ, Kahn BB. Exercise, glucose transport, and insulin sensitivity. Ann Rev Med 1998; 49: 235 – 61.
- 8.
Manson JE, Nathan DM, Krolewski AS, Stampfer MJ, Willett WC, Hennekens CH. A prospective study of exercise and incidence of diabetes among US male physicians. JAMA 1992; 268: 63 – 7.
- 9.
Manson JE, Rimm EB, Stampfer MJ, Colditz GA, Willett WC, Krolewski AS et al. Physical activity and incidence of non-insulin-dependent diabetes mellitus in women. Lancet 1991; 338: 774 – 8.
- 10.
Hu FB, Sigal RJ, Rich-Edwards JW, Colditz GA, Solomon CG, Willett WC et al. Walking compared with vigorous physical activity and risk of type 2 diabetes in women. JAMA 1999; 282: 1433 – 9.
- 11.
Helmrich SP, Ragland DR, Leung RW, Paffenbarger R. Physical activity and reduced occurence of non-insulin-dependent diabets mellitus. N Engl J Med 1991; 325: 147 – 52.
- 12.
Lynch J, Helmrich SP, Lakka TA, Kaplan GA, Cohen RD, Salonen R et al. Moderately intense physical activities and high levels of cardiorespiratory fitness reduce the risk of non-insulin-dependent diabetes mellitus in middle-aged men. Arch Intern Med 1996; 156: 1307 – 14.
- 13.
Barker DJP, Hales CN, Osmond C, Phibbs K, Clark PMS. Type 2 (non-insulin-dependent) diabetes mellitus, hypertension and hyperlipidaemia (syndrome X): relation to reduced fetal growth. Diabetologia 1993; 36: 62 – 7.
- 14.
Rimm EB, Chan J, Stampfer MJ, Colditz GA, Willett WC. Prospective study of cigarette smoking, alcohol use, and the risk of diabetes in men. BMJ 1995; 310: 555 – 9.
- 15.
Perry IJ, Wannamethee SG, Walker MK, Thomson AG, Whincup PH, Shaper AG. Prospective study of risk factors for development of non-insulin dependent diabetes in middle aged British men. BMJ 1995; 310: 560 – 4.
- 16.
Skarfors E, Selinus KI, Lithell HO. Risk factors for developing non-insulin dependent diabets: a 10 year follow up of men in Uppsala. BMJ 1991; 303: 755 – 60.
- 17.
Alberti KGMM, Zimmet PZ. Definition, diagnosis and classification of diabetes mellitus and its complications part 1: diagnosis and classification of diabetes mellitus – provisional report of a WHO consultation. Diabet Med 1998; 15: 539 – 53.
- 18.
Ajani UA, Hennekens CH, Spelsberg A, Manson JA. Alchol consumption and risk of type 2 diabetes mellitus among US male physicians. Arch Intern Med 2000; 160: 1025 – 30.
- 19.
Pan XR, Li GW, Hu YH, Wang JX, Yang WY, An ZX et al. Effects of diet and exercise in preventing NIDDM in people with impared glucose tolerance – The Da Quing IGT and diabetes study. Diabetes Care 1997; 20: 537 – 44.
- 20.
Anderssen SA, Hjermann I, Urdal P, Torjesen PA, Holme I. Improved carbohydrate metabolism after physical training and dietary intervention in individuals with the «atherothrombogenic syndrome». Oslo Diet and Exercise Study (ODES). A randomized trial. J Intern Med 1996; 240: 203 – 9.
- 21.
Charles MA, Eschwege E. Prevention of type 2 diabetes: role of metformin. Drugs 1999; 58: 71 – 82.
- 22.
Sartor G, Schersten B, Carlström S, Melander A, Norden Å, Persson G. Ten-year follow-up of subjects with impaired glucose tolerance. Diabetes 1980; 29: 41 – 9.
- 23.
Nolan JJ, Ludvik B, Beerdsen P, Joyce M, Olefsky J. Improvement in glucose-tolerance and insulin-resistance in obese subjects treated with troglitazone. N Engl J Med 1994; 331: 1188 – 93.
- 24.
The diabetes prevention program research group. The diabetes prevention program. Design and methods for a clinical trial in the prevention of type 2 diabetes. Diabetes Care 1999; 22: 623 – 34.
- 25.
Nightingale SL. Orlistat approved for obesity. JAMA 1999; 281: 1978.
- 26.
Heymsfield SB, Segal KR, Hauptman J, Lucas CP, Boldrin MN, Rissanen A et al. Effects of weight loss with orlistat on glucose tolerance and progression to type 2 diabetes in obese adults. Arch Intern Med 2000; 160: 1321 – 6.
- 27.
Chiasson JL, Gomis R, Hanfeeld M, Josse RG, Karasik A, Laakso M. The STOP-NIDDM trial. Diabetes Care 1998; 21: 1720 – 5.
- 28.
Eriksson J, Lindström J, Valle T, Aunola S, Hämäläinen H, Ilanne-Parikka P et al. Prevention of type II diabetes in subjects with impaired glucose tolerance: the Diabetes Prevention Study (DPS) in Finland. Diabetologia 1999; 42: 793 – 801.
- 29.
Torgerson J, Käppi M, Arlinger K, Bergmark G, Lantz H, Sjöström L. The XENDOS Study: logistics and outcome of recruitment. Abstrakt. Diabetes 1998; 47: A 1324.
- 30.
Goyder E, Irwig L. Screening for diabetes: what are we really doing? BMJ 1998; 317: 1644 – 6.
- 31.
Eriksson KF, Lindgärde F. No excess 12-year mortability in men with impaired glucose tolerance who participated in the Malmö Preventive Trial with diet and exercise. Diabetologia 1998; 41: 1010 – 6.
- 32.
Forebyggende behandling av type 2-diabetes. Konsensuskonferanse. Teknisk rapport nr. 11. Oslo: Norges forskningsråd, 1996.
- 33.
Aasal JP. Primary Prevention of NIDDM: a future dream. Diabetes/Metab Rev 1997; 13: 113 – 7.?