Background
. Modern antiretroviral treatment has improved the prognosis in chronic HIV-infection dramatically during the last decade; but the treatment is expensive, the drugs are toxic, and viral resistance is a problem. An alternative approach is therapeutic immunization. This treatment aims to improve the patients’ own HIV-specific immune responses and thereby control the HIV-infection and suppress disease progression.
Material and methods
. The article reviews therapeutic immunization in chronic HIV-infection, provides a brief overview of the immunopathogenesis of AIDS, and is partly based on studies performed at Ullevål University Hospital.
Results and interpretation
. Although different strategies for immune modulation in HIV-infection have shown to induce good, HIV-specific immune responses, there has been no definite documentation of clinical benefit so far. The most promising results have been obtained by immunizing patients with injections of virus-stimulated autologous dendritic cells, demonstrating a significant reduction of the viral load. The method is complex and therefore only feasible for individualised therapy in highly specialized clinics. At Ullevål University Hospital, we have in collaboration with Bionor Immuno recently conducted studies with a therapeutic immunization candidate Vacc-4x. Vacc-4x improves HIV-specific immune responses by stimulating skin dendritic cells with HIV-like peptides. Provision of efficient therapeutic immunization methods in chronic HIV-infection seems to be more realistic now than a few years ago. These methods may postpone and even reduce the need for antiretroviral treatment, and might also be beneficial if used as prophylactic immunization.
Det er i år 25 år siden de første rapportene om uforklarlige utbrudd av Pneumocystis jiroveci og Kaposis sarkom blant unge, tidligere friske homoseksuelle menn i California og New York. Noen tid etter ble et retrovirus, som vi i dag kjenner som humant immunsviktvirus type 1 (hiv), identifisert som årsak til dette syndromet. Dette var begynnelsen på en pandemi der mer enn 25 millioner menneskeliv så langt er tapt.
Siden 1981 er det gjort en rekke viktige fremskritt innen sykdomsforståelse og ikke minst behandling av hivinfeksjon, men mange viktige spørsmål gjenstår. Til tross for stadig økende kunnskap om de komplekse interaksjonene mellom hiv og immunsystemet er det fortsatt ikke utviklet noen trygg og effektiv vaksine mot hiv, verken for å forebygge infeksjon eller for å bremse sykdomsutviklingen. I denne artikkelen tar vi sikte på å gi en kortfattet oversikt over immunpatogenesen ved aids, for deretter å diskutere terapeutisk immunisering som en mulig modalitet i behandlingen av hivinfeksjon.
Behov for alternative behandlingsstrategier?
Moderne antiretroviral kombinasjonsbehandling bremser hivreplikasjonen med doseavhengig hemming av hivenzymene revers transkriptase og protease, og nye medikamentklasser er under utvikling. I løpet av det siste tiåret har bruken av slike midler ført til en dramatisk reduksjon av hivrelatert sykelighet og dødelighet, men bare i vår del av verden. Slik behandling er svært kostbar og derfor lite tilgjengelig i fattige land – der det er flest hivsmittede. Men selv i rike land er ikke antiretroviral behandling uproblematisk. Den kan være forbundet med betydelige bivirkninger på kortere eller lengre sikt, effektene av langtidsbruk er usikre og resistens er et økende problem. Videre vet man at selv langvarig antiretroviral behandling ikke utrydder viruset hos pasientene fullstendig, bl.a. fordi det finnes virusreservoarer med persisterende lavgradig virusreplikasjon på tross av antiretrovirale medikamenter i adekvate doser. Behandlingen må derfor være livslang. Selv om immunforsvaret delvis restitueres etter langvarig bruk av hivmedisiner, får pasientene mest en ekspansjon av de eksisterende T-cellekloner. Faktisk tyder data på at de spesifikke immunresponsene mot hiv faktisk svekkes under slik behandling, i fravær av hivantigen (1).
Til tross for at det altså finnes effektive måter å kontrollere hivinfeksjonen på, er det behov for nye, effektive behandlingsformer. Vaksiner og immunbaserte terapiformer representerer slike alternative behandlingsprinsipper, og de kan være billigere og lettere å administrere enn hivmedisiner. Målet er å forhindre sykdomsprogrediering, enten ved å indusere nye eller modulere spesifikke immunresponser for bedre å kontrollere hivinfeksjonen eller ved å bremse de immunpatologiske prosessene som indirekte gjør stor skade ved kronisk hivinfeksjon. Av generell immunmodulerende behandling er det bl.a. forsøkt å potensere immunresponser ved passiv tilførsel av antistoffer (2) eller ulike cytokiner (3) samt bremse ugunstig immunaktivering ved f.eks. antiinflammatorisk behandling (4, 5). Med vaksinasjon eller immunisering ønsker man å bedre hivspesifikke immunresponser, enten profylaktisk, der målet er fullstendig beskyttelse mot initial infeksjon, eller terapeutisk, ved å indusere immunresponser som hindrer sykdomsprogrediering i pasienter som allerede er infisert med hiv.
Det første slaget rammer hardest
Hiv rammer først og fremst immunsystemet og kjennetegnes av et suksessivt tap av CD4-positive T-celler, såkalte T-hjelpeceller. Disse er helt sentrale i initieringen og opprettholdelsen av de fleste immunologiske prosesser, men er dessverre også de viktigste målcellene for hiv. Den immunsvikt man til slutt observerer ved ubehandlet hivinfeksjon, skyldes en kombinasjon av dysfunksjon og redusert antall CD4-positive T-celler, noe som etter hvert gir klinisk immunsvikt med opportunistiske infeksjoner og spesielle neoplasier. Det store tapet av CD4-positive T-celler er tradisjonelt blitt sett på som et gradvis tap i den relativt lange asymptomatiske «inkubasjonsperioden» mellom akutt hivinfeksjon og langtkommet aids, uten at disse mekanismene er blitt forstått fullstendig (6). Nyere studier har imidlertid vist at den kvantitativt største deplesjonen av CD4-positive T-celler skjer svært tidlig i den akutte infeksjonen, faktisk før immunresponsene mot hiv har kommet i gang (7, 8). Mesteparten av dette celletapet finner trolig sted i mucosaassosiert lymfoid vev i tarmen, der en stor del av kroppens T-celler finnes. En betydelig andel av disse T-cellene er hukommelsesceller som uttrykker lave nivåer av overflate-CCR5-kjemokinreseptorer, men samtidig er nivåene tilstrekkelig høye til at hiv smitter en stor andel av disse. CCR5 er den viktigste koreseptor (sammen med CD4) som viruset bruker for å komme inn i celler. Dermed får man en massiv destruksjon av CD4-positive hukommelsesceller helt i starten av hivinfeksjonen, trolig forårsaket av virusbetinget cytolyse (8). Denne immunologiske skaden restitueres antakelig aldri fullstendig, selv ikke etter langvarig antiretroviral behandling (1).
Immunresponser ved kronisk hivinfeksjon
Til tross for fravær av kliniske symptomer i den asymptomatiske latensperioden som følger etter akutt hivinfeksjon, pågår det en gradvis progredierende immunsvikt. Mens akutt hivinfeksjon kjennetegnes av et raskt og massivt tap av CD4-positive T-celler, prøver immunsystemet både å kontrollere viruset og å rekonstituere seg i den kroniske fasen – med flere uheldige effekter på lengre sikt. Det persisterende nærværet av hivantigen får spesielt to uheldige konsekvenser. For det første skjer det et skifte av hivspesifikke T-celler over til mer kortlivede, aktiverte T-celler. Slik aktivering, som jo er svært nyttig ved alle andre infeksjoner, gjør disse T-cellene i stedet spesielt mottakelige for hivinfeksjon selv, noe som fører til ytterligere reduksjon i antall hivspesifikke T-celler (9) (fig 1). For det andre medfører den kontinuerlige eksponeringen for hivantigen en tilstand av persisterende og til slutt ugunstig generalisert immunaktivering som langsomt utmatter immunsystemet. Graden av slik kronisk generell immunaktivering ved kronisk hivinfeksjon er sterkt assosiert med sykdomsprogrediering, og markører for slike prosesser er kanskje blant de beste prognostiske prediktorer vi har (4, 10). Data tyder på at ekspresjon av aktiveringsmarkøren CD38 på CD8-positive T-celler kan være en mulig enda bedre prediktor for sykdomsprogrediering enn mer tradisjonelle og veldokumenterte markører som CD4 og hiv-RNA (11).
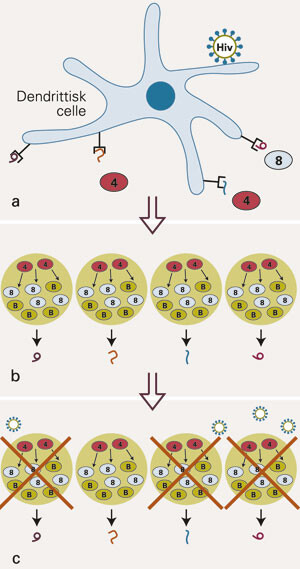
Man vet nå at hivspesifikke cellulære immunresponser, og kanskje særlig de som er mediert av CD8-positive cytotoksiske T-celler, er essensielle for til en viss grad å kunne kontrollere hivreplikasjonen – høye nivåer av slike hivspesifikke CD8-positive celler er sterkt assosiert med en langsom, benign utvikling av hivinfeksjonen. Men hos de fleste reduseres eller tapes de kraftige hivinduserte immunresponsene i det lange løp, parallelt med at de fleste armer av immunsystemet gradvis blir dysfunksjonelle. Sentralt her er igjen tapet av CD4-positive T-celler, som f.eks. resulterer i utilstrekkelig vedlikehold av hivspesifikke CD8-positive T-celler, slik at disse både blir færre og ineffektive. I stadier med avansert immunsvikt er reduksjonen i antall CD8-positive T-celler i seg selv er en viktig prediktor for sykdomsprogrediering (12). Parallelt hemmes flere CD8-positive T-cellefunksjoner, i form av redusert kapasitet i cytokinproduksjon, cytotoksisitet og proliferasjon (13). I tillegg til denne uheldige utviklingen bidrar også virale faktorer til at hiv kan unnslippe immunkontroll. En naturlig høy mutasjonsfrekvens av hiv vil kunne selektere ut mutanter med skifte av en eller flere aminosyrer i dominante epitoper for cytotoksiske hivspesifikke T-celler, såkalte unnslippelsesmutanter (escape mutants). Små sekvensendringer vil kunne være tilstrekkelig til at viruset kan unngå gjenkjennelse av etablerte T-cellekloner. Videre kan enkelte virale komponenter nedregulere HLA-klasse 1-molekyler, som har som oppgave å bringe viruspeptider til celleoverflaten slik at infiserte celler kan gjenkjennes og drepes av cytotoksiske T-celler (14). Mekanismer for utvikling av immunsvikt ved hivinfeksjon er fremstilt skjematisk i figur 2.
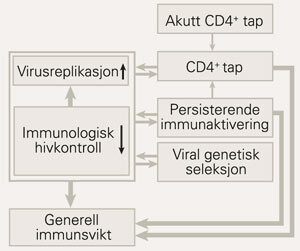
De immunpatologiske prosessene ved hivinfeksjon er kompliserte og sammensatte, og dette gjenspeiles i den store individuelle variasjonen man ser i utviklingen av klinisk sykdom. Enkelte pasienter utvikler immunsvikt raskt og infeksjonen progredierer til aids i løpet av få år, mens 1 – 2 % forblir asymptomatiske i årevis (long-term non-progressors, LTNP) uten behandling, med lav virusreplikasjon og uten å vise tegn til immunsvikt (15). Årsakene til manglende sykdomsprogrediering hos denne pasientgruppen er ikke klarlagt, men trolig skyldes det et samspill mellom multiple faktorer knyttet til henholdsvis vert eller virus (16).
Utfordringer i utviklingen av en hivvaksine
De fleste strategier for terapeutisk immunisering tar sikte på å indusere cellulære immunresponser, og særlig kraftige, varige cytotoksiske T-celleresponser er ønskelig. Et adekvat antall velfungerende CD4-positive T-celler er nødvendig for å indusere og opprettholde effektive immunresponser. Derfor vil kombinasjonen av det massive selektive tap av slike T-celler i den akutte fasen og den generelle cellulære immunologiske dysfunksjonen man ser ved kronisk hivinfeksjon gjøre det vanskelig å vedlikeholde gode hivspesifikke immunresponser naturlig. Det er spesielt tapet av hivspesifikke T-cellekloner man ønsker å reparere ved terapeutisk immunisering. Pilotundersøkelser har vist at hivspesifikke T-celleresponser faktisk kan nydannes med immunisering allerede rett etter den første akutte sykdomsfasen (17).
Hiv gir en livslang infeksjon, og til tross for at det finnes langtidsoverlevere, er det ikke rapportert tilfeller der en smittet har klart å bli kvitt viruset fullstendig etter etablert smitte. Det betyr at en effektiv vaksine mot hiv må kunne indusere immunresponser som er mer potente enn dem man vanligvis ser ved naturlig forløp av hivinfeksjon. Et hovedproblem er at det hersker stor usikkerhet om hva effektiv immunitet innebærer – hvilke virusproteiner som det er viktig å bli immunisert mot, og hvilke responser som er kvalitativt best. En annen utfordring ved vaksineutvikling er graden av genetisk variabilitet, både hos vert og virus. Det er jo en betydelig grad av HLA-polymorfisme pasientene imellom, noe som gjør at samme antigen dels vil presenteres og dels gjenkjennes ulikt. Viral genetisk variasjon vil gjøre det vanskelig å finne en vaksine som er effektiv mot alle virusstammer. Vaksiner må derfor trolig best representere konserverte deler av virusproteinene, som dermed har mindre variabilitet. Totalt sett er det også mulig at disse variable faktorene gjør at slik terapi bør individualiseres, enten med variabel dosering eller med ulik sammensetning av antigener.
Ved hjelp av profylaktiske vaksiner har man tradisjonelt forsøkt å indusere nøytraliserende antistoffer for å oppnå fullstendig beskyttelse mot infeksjon, såkalt steril immunitet. Det er fortsatt uklart hvilken rolle humorale responser spiller i forsvaret mot hivinfeksjon. Potente nøytraliserende antistoffer genereres tidlig i den akutte fasen, men unnslippelsesmutasjoner oppstår svært raskt (2). Trolig kan antistoffer spille en viss rolle i blokkering av viruspartikler og mediering av destruksjon av virioner, men mye tyder på at det krever betydelig høyere titre enn de som opptrer i det naturlige forløp av en hivinfeksjon (18).
Så langt har det vist seg ekstremt vanskelig å oppnå fullstendig beskyttelse med profylaktiske hivvaksiner. I 2003 forelå resultatene fra de første kliniske fase 3-aidsvaksinestudier med over 5 000 pasienter, og resultatene var nedslående (19). Et realistisk scenario fremover er trolig at man også ved profylaktisk vaksinering ønsker å indusere cellulære immunresponser som ikke nødvendigvis forhindrer smitte fullstendig, men som snarere begrenser sykdomsprogredieringen etter eventuell smitte. Dermed synes målet for og utviklingen av terapeutiske vaksiner og profylaktiske vaksiner å konvergere.
Terapeutisk vaksinering
Terapeutisk immunisering kan etter hvert muligens bli en viktig behandlingsmodalitet ved hivinfeksjon, helst som et alternativ, men kanskje mer sannsynlig som et supplement til antiretrovirale medikamenter. Målet er å indusere hivspesifikke immunresponser mediert av både CD4-positive og CD8-positive T-celler som er i stand til å kontrollere infeksjonen bedre og dermed bremse utviklingen mot klinisk immunsvikt. Et bredt spekter av ulike strategier og vaksinekandidater er under utprøvning, inkludert inaktivert helt virus, rekombinante proteiner, syntetiske peptider eller lipopeptider, virusliknende partikler, DNA-vaksiner, levende virale eller bakterielle vektorbaserte vaksiner og vaksiner basert på autologe dendrittiske celler pulset med virale antigener (20).
I de senere år har mye ressurser gått til utvikling av DNA- eller vektorbaserte strategier for å stimulere CD8-positive T-celleresponser. Intramuskulær injeksjon av DNA-plasmider som inneholder hivgener tas opp av muskelceller, disse produserer virale T-celleimmunogene proteiner som immunsystemet «ser» via HLA-klasse 1-molekyler på overflaten. I humane studier har disse immunresponsene vist seg å være forbigående og svakere enn det man skulle forvente ut fra dyreforsøk (20, 21). Responsene kan forsterkes på ulike måter for å oppnå sterkere og mer varige immunresponser; enten ved hjelp av ulike cytokinadjuvanter eller med gjentatte immuniseringer i regimer med primer og forsterkningsdoser (prime – boost) (20). Dette innebærer gjentatt administrasjon av samme antigen med to ulike immuniseringsmetoder. Ofte gis et DNA-plasmid for å sette i gang immunresponsen (prime), mens den andre dosen kan være en vektorbasert vaksine som brukes for å forsterke responsen (boost) (22). Det er også flere pågående studier med ulike virale vektorer som uttrykker hivgensekvenser. Modifisert Vaccinia Ankara (MVA) og ulike poxvirus utforskes som vektorkandidater, men resultatene så langt er inkonklusive (23) – (25). Derimot er det nylig vist at en kombinasjon av en viral vektor-vaksine (canaripox), en lipopeptidvaksine og interleukin-2 har gitt gode immunresponser, bedret viral kontroll og redusert behov for antiviral terapi (26, 27).
De hittil kanskje mest lovende resultatene med terapeutisk immunisering er oppnådd ved hjelp av en teknikk basert på autologe dendrittiske celler stimulert ex vivo med pasientens eget virus og deretter reinjisert i pasienten. En fransk forskergruppe fant mer enn 90 % reduksjon av plasma-hiv-RNA i åtte av 18 pasienter etter ett år og god korrelasjon mellom viral kontroll og funksjonelle CD4-positive og CD8-positive T-celleresponser (28). En spansk studie har også vist bedret viral kontroll hos noen pasienter etter immunisering med denne teknikken (29). Ingen av disse resultatene er foreløpig bekreftet i kontrollerte studier. Selv om vaksiner basert på dendrittiske celler virker lovende, er de teknikkene som her benyttes svært komplekse og kun gjennomførbare som individualisert behandling i høyspesialiserte klinikker. Studiene er likevel prinsipielt viktige fordi de demonstrerer at det er mulig å oppnå bedret viral kontroll ved kronisk hivinfeksjon ved hjelp av terapeutisk immunisering.
Det finnes også enklere teknikker som bygger på de samme prinsippene, men der dendrittiske celler i huden aktiveres og stimuleres med antigen direkte in vivo. En av disse metodene benytter seg av transdermal levering av antigen ved hjelp av topikal applisering av DNA-plasmid direkte på huden (30). Teknikken er enkel og ikke-invasiv og har i prekliniske studier vist reduserte virusnivåer hos kronisk infiserte aper (31).
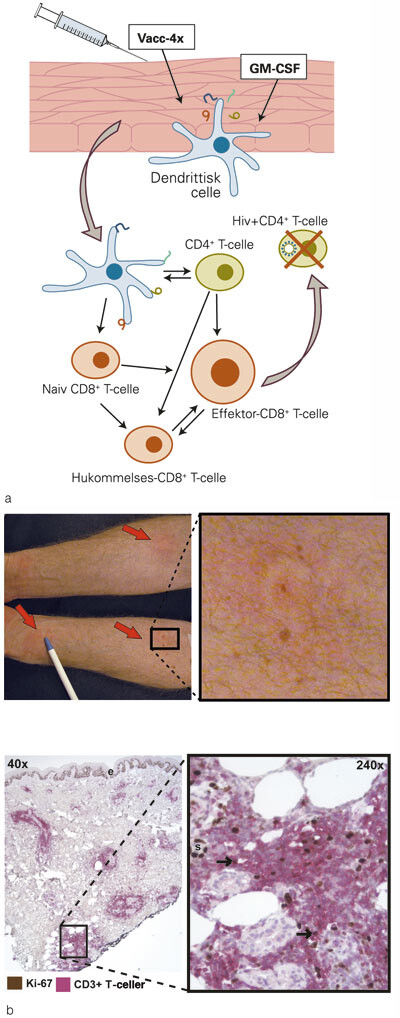
En annen variant er en peptidbasert vaksinekandidat (Vacc-4x) som er utviklet av det norske bioteknologifirmaet Bionor Immuno. Allerede i 2001 ble det gjort fase 1-utprøvninger ved Haukeland Universitetssjukehus (32). Vacc-4x består av fire hivassosierte peptider som korresponderer med konserverte områder i genomet for svært mange hivstammer. Peptidene gis intradermalt sammen med en vekstfaktor (GM-CSF) for å stimulere og modne dendrittiske celler i huden (fig 3a) (33). Vi har nylig gjennomført kliniske studier ved Infeksjonsmedisinsk avdeling, Ullevål universitetssykehus, og det ble dokumentert god evne til immunisering med denne metodikken hos pasienter med kronisk hivinfeksjon (fig 3b) (34, 35). Dessuten var det lovende relasjoner mellom immuniseringsgrad og bedret immunologisk kontroll av hiv og mindre tap av CD4-positive T-celler i perioder uten antiretrovirale medisiner (34, 35). Oppfølgingsstudier 1,5 år etter siste immunisering viste at 62 % av pasientene fortsatt klarte seg uten antiretroviral behandling. Man så også at det var pasientene med best vaksineresponser som klarte seg lengst uten behandling (36), men randomiserte, placebokontrollerte studier er nødvendig for å bekrefte kliniske effekter. Vi har også for første gang sammenliknet immunisering hos hivpositive som henholdsvis bruker eller ikke bruker antiretroviral behandling under immuniseringen, og det var overraskende små forskjeller. Det vil kunne ha store praktiske implikasjoner i fattige land dersom slike vaksiner kan gis uten samtidig behandling med dyre antiretrovirale medikamenter.
Konklusjon
En effektiv terapeutisk vaksine vil kunne få store implikasjoner for behandlingen av hivinfeksjon i fremtiden, særlig i de deler av verden der moderne antiretroviral behandling ikke er noe reelt tilbud. Hull i den hivspesifikke immuniteten utvikles rett etter smitte og blir større over tid ved kronisk hivinfeksjon. Målet med terapeutisk immunisering er å reparere disse hullene ved å indusere spesifikke og effektive immunresponser som gir klinisk effekt. Preliminære rapporter tyder på at det er mulig å bedre den immunologiske kontrollen av hivinfeksjonen med terapeutisk immunisering, som dermed kan bli et nyttig supplement til antiretrovirale medisiner. Det kan gi innsparinger i form av mindre sykelighet, færre bivirkninger og lavere kostnader. Imidlertid vil det fortsatt være usikkerhet rundt varigheten av både immunresponsene og de antivirale effektene, og variasjoner i både verts- og virusfaktorer gjør at man kanskje må individualisere slik immunterapi.
Forhåpentligvis vil man i årene fremover kunne utvikle en effektiv terapeutisk vaksine mot hiv som det også er mulig å administrere i stor skala. I dag synes det som om slik forskning samtidig også vil kunne utvikle de beste alternativene for det verden trenger aller mest – nemlig en forebyggende hivvaksine.
Oppgitte interessekonflikter: Ingen
- 1.
Autran B, Costagliola D, Murphy R et al. Evaluating therapeutic vaccines in patients infected with HIV. Expert Rev Vaccines 2004; 3 (4 suppl): S169 – 77.
- 2.
Trkola A, Kuster H, Rusert P et al. Delay of HIV-1 rebound after cessation of antiretroviral therapy through passive transfer of human neutralizing antibodies. Nat Med 2005; 11: 615 – 22.
- 3.
Kovacs JA, Lempicki RA, Sidorov IA et al. Induction of prolonged survival of CD4+ T lymphocytes by intermittent IL-2 therapy in HIV-infected patients. J Clin Invest 2005; 115: 2139 – 48.
- 4.
Kvale D, Ormaasen V, Kran AM et al. Immune modulatory effects of cyclooxygenase type 2 inhibitors in HIV patients on combination antiretroviral treatment. AIDS 2006; 20: 813 – 20.
- 5.
Andrieu JM, Lu W, Levy R. Sustained increases in CD4 cell counts in asymptomatic human immunodeficiency virus type 1-seropositive patients treated with prednisolone for 1 year. J Infect Dis 1995; 171: 523 – 30.
- 6.
Douek DC, Picker LJ, Koup RA. T cell dynamics in HIV-1 infection. Annu Rev Immunol 2003; 21: 265 – 304.
- 7.
Brenchley JM, Schacker TW, Ruff LE et al. CD4+ T cell depletion during all stages of HIV disease occurs predominantly in the gastrointestinal tract. J Exp Med 2004; 6: 749 – 59.
- 8.
Mehandru S, Poles MA, Tenner-Racz K et al. Primary HIV-1 infection is associated with preferential depletion of CD4+ T lymphocytes from effector sites in the gastrointestinal tract. J Exp Med 2004; 200: 761 – 70.
- 9.
Douek DC, Brenchley JM, Betts MR et al. HIV preferentially infects HIV-specific CD4+ T cells. Nature 2002; 417: 95 – 8.
- 10.
Silvestri G, Feinberg MB. Turnover of lymphocytes and conceptual paradigms in HIV infection. J Clin Invest 2003; 112: 821 – 4.
- 11.
Giorgi JV, Lyles RH, Matud JL et al. Predictive value of immunologic and virologic markers after long or short duration of HIV-1 infection. J Acquir Immune Defic Syndr 2002; 29: 346 – 55.
- 12.
Kvale D, Aukrust P, Osnes K et al. CD4+ and CD8+ lymphocytes and HIV RNA in HIV infection: high baseline counts and in particular rapid decrease of CD8+ lymphocytes predict AIDS. AIDS 1999; 13: 195 – 201.
- 13.
Migueles SA, Laborico AC, Shupert WL et al. HIV-specific CD8+ T cell proliferation is coupled to perforin expression and is maintained in nonprogressors. Nat Immunol 2002; 3: 1061 – 8.
- 14.
McMichael AJ, Rowland-Jones SL. Cellular immune responses to HIV. Nature 2001; 410: 980 – 7.
- 15.
Sheppard HW, Lang W, Ascher MS et al. The characterization of non-progressors: long-term HIV-1 infection with stable CD4+ T-cell levels. AIDS 1993; 7: 1159 – 66.
- 16.
Rodes B, Toro C, Paxinos E et al. Differences in disease progression in a cohort of long-term non-progressors after more than 16 years of HIV-1 infection. AIDS 2004; 18: 1109 – 16.
- 17.
Lichterfeld M, Kaufmann DE, Yu XG et al. Loss of HIV-1-specific CD8+ T cell proliferation after acute HIV-1 infection and restoration by vaccine-induced HIV-1-specific CD4+ T cells. J Exp Med 2004; 200: 701 – 12.
- 18.
Haigwood NL, Stamatatos L. Role of neutralizing antibodies in HIV infection. AIDS 2003; 17 (suppl 4): 67 – 71.
- 19.
Pitisuttithum P. HIV-1 prophylactic vaccine trials in Thailand. Curr HIV Res 2005; 3: 17 – 30.
- 20.
Dorrell L. Therapeutic immunization strategies for the control of HIV-1. Expert Rev Vaccines 2005; 4: 513 – 20.
- 21.
Dorrell L, Yang H, Iversen AK et al. Therapeutic immunization of highly active antiretroviral therapy-treated HIV-1-infected patients: safety and immunogenicity of an HIV-1 gag/poly-epitope DNA vaccine. AIDS 2005; 19: 1321 – 3.
- 22.
Goonetilleke N, Moore S, Dally L et al. Induction of multifunctional human immunodeficiency virus type 1 (HIV-1)-specific T cells capable of proliferation in healthy subjects by using a prime-boost regimen of DNA- and modified vaccinia virus Ankara-vectored vaccines expressing HIV-1 Gag coupled to CD8+ T-cell epitopes. J Virol 2006; 80: 4717 – 28.
- 23.
Tubiana R, Carcelain G, Vray M et al. Therapeutic immunization with a human immunodeficiency virus (HIV) type 1-recombinant canarypox vaccine in chronically HIV-infected patients: the Vacciter Study (ANRS 094). Vaccine 2005; 23: 4292 – 301.
- 24.
Cosma A, Nagaraj R, Buhler S et al. Therapeutic vaccination with MVA-HIV-1 nef elicits Nef-specific T-helper cell responses in chronically HIV-1 infected individuals. Vaccine 2003; 22: 21 – 9.
- 25.
Harrer E, Bauerle M, Ferstl B et al. Therapeutic vaccination of HIV-1-infected patients on HAART with a recombinant HIV-1 nef-expressing MVA: safety, immunogenicity and influence on viral load during treatment interruption. Antivir Ther 2005; 10: 285 – 300.
- 26.
Levy Y, Gahery-Segard H, Durier C et al. Immunological and virological efficacy of a therapeutic immunization combined with interleukin-2 in chronically HIV-1 infected patients. AIDS 2005; 19: 279 – 86.
- 27.
Levy Y, Durier C, Lascaux AS et al. Sustained control of viremia following therapeutic immunization in chronically HIV-1-infected individuals. AIDS 2006; 20: 405 – 13.
- 28.
Lu W, Arraes LC, Ferreira WT et al. Therapeutic dendritic-cell vaccine for chronic HIV-1 infection. Nat Med 2004; 10: 1359 – 65.
- 29.
Garcia F, Lejeune M, Climent N et al. Therapeutic immunization with dendritic cells loaded with heat-inactivated autologous HIV-1 in patients with chronic HIV-1 infection. J Infect Dis 2005; 191: 1680 – 5.
- 30.
Lori F, Trocio J, Bakare N et al. DermaVir, a novel HIV immunisation technology. Vaccine 2005; 23: 2030 – 4.
- 31.
Lisziewicz J, Trocio J, Xu J et al. Control of viral rebound through therapeutic immunization with DermaVir. AIDS 2005; 19: 35 – 43.
- 32.
Asjo B, Stavang H, Sorensen B et al. Phase I trial of a therapeutic HIV type 1 vaccine, Vacc-4x, in HIV type 1-infected individuals with or without antiretroviral therapy. AIDS Res Hum Retroviruses 2002; 18: 1357 – 65.
- 33.
Kvale D, Kran AM, Sommerfelt MA et al. Divergent in vitro and in vivo correlates of HIV-specific T-cell responses during onset of HIV viraemia. AIDS 2005; 19: 563 – 7.
- 34.
Kran AM, Sorensen B, Nyhus J et al. HLA- and dose-dependent immunogenicity of a peptide-based HIV-1 immunotherapy candidate (Vacc-4x). AIDS 2004; 18: 1875 – 83.
- 35.
Kran AM, Sommerfelt MA, Sorensen B et al. Reduced viral burden amongst high responder patients following HIV-1 p24 peptide-based therapeutic immunization. Vaccine 2005; 23: 4011 – 5.
- 36.
Kran AM, Sorensen B, Sommerfelt MA et al. Long-term HIV-specific responses and delayed resumption of antiretroviral therapy after peptide immunization targeting dendritic cells. AIDS 2006; 20: 627 – 30.