Background.
Pancreatic adenocarcinoma is a relatively frequent cancer with an extremely poor prognosis. Until recently, the natural history of pancreatic adenocarcinoma has not been possible to study, but the identification of precursor lesions (pancreatic intraepithelial neoplasia, PanIN) has lead to a better understanding of the stepwise morphological and genetic alterations involved in the development of invasive adenocarcinoma.
Material and methods.
Relevant literature from the period of 1996 – 2005 was found by searching the Medline database, combining the terms «pancreas», «cancer», «PanIN» and «neoplasia». Principal original and review papers were extracted and used as background for a presentation of the PanIN cancer progression model.
Results and interpretation.
PanINs are established as designation of histological precursor lesions to pancreatic adenocarcinoma. PanIN grade I to III represent stepwise morphological alterations in the pancreatic ductal epithelium, from early neoplasia (PanIN I and II), via carcinoma in situ (PanIN III) to the development of invasive ductal adenocarcinoma. This model allows for the investigation of sequential molecular changes such as activation of oncogenes and inactivation of tumour suppressor genes. Increased knowledge about pancreatic carcinogenesis may pave the way for prevention strategies, early detection, and new treatment options, thus ultimately improving the prognosis of the patients.
Kreft i bukspyttkjertelen er den femte vanligste årsaken til kreftdødsfall i vestlige land. Årlig får rundt 600 nordmenn denne diagnosen, og nær 97 % vil dø av sykdommen innen fem år. Kirurgi er eneste mulige kurative behandling, men kun 10 – 15 % av pasientene er operable ved diagnosetidspunktet (1). Kjemoterapi og strålebehandling er tilgjengelig fortrinnsvis som palliativ behandling, og pasienter med avansert sykdom har en median overlevelse på rundt ni måneder. Årsaken til pancreascancer er uklar, men de sterkeste risikofaktorene er alder (median alder for debut er rundt 65 år), røyking og sykdomstilstander som diabetes og kronisk pankreatitt (1). Hos rundt 10 % av pasientene med kreft i bukspyttkjertelen foreligger det en arvelig risiko, som for eksempel kimbanemutasjon i genene BRCA2 (brystkreft og pancreaskreft), CDKN2A (malignt melanom og pancreaskreft), STK11 (Peutz-Jeghers syndrom) eller PRSS1 (arvelig kronisk pankreatitt) (1, 2). Begrensede behandlingsmuligheter og den dårlige prognosen har stimulert til forskning på de molekylærbiologiske mekanismene som er involvert i kreftutvikling i bukspyttkjertelen (3). Kunnskap om de første biologiske forandringene kan gi mulighet for forebygging, tidlig oppdagelse og nye behandlingsmetoder for denne sykdommen (1, 3, 4).
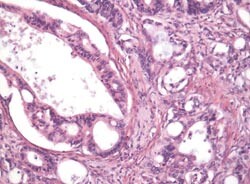
Ved studier av kreft i eksokrine pancreas er det viktig å skille mellom duktalt adenokarsinom og andre, sjeldnere svulsttyper (tab 1), ofte med annen tumorbiologi og gjerne betydelig bedre prognose (2, 5) – (7). Også nevroendokrine svulster (f.eks. insulinomer) opptrer i bukspyttkjertelen. Disse må holdes atskilt på bakgrunn av særegne biologiske og kliniske kjennetegn. Den videre beskrivelse av kreft i bukspyttkjertelen vil omhandle duktalt adenokarsinom (fig 1).
Tabell 1
Oversikt over ondartede svulster i eksokrine pancreas (modifisert etter WHO) (2)
| Type |
Andel (%) |
| Duktalt adenokarsinom |
85 – 90 |
| Serøse og mucinøse cystiske adenokarsinomer |
2 – 5 |
| Intraduktalt papillærmucinøst karsinom |
1 – 3 |
| Solid pseudopapillært karsinom |
1 – 2 |
| Acinærcellekarsinom |
< 1 |
| Pankreatoblastom |
< 1 |
| Andre |
< 1 |
Relativt nylig er forstadier til pancreascancer, såkalte pankreatiske intraepiteliale neoplasier (PanIN), definert og karakterisert (3, 8) – (12). Trinnvise histologiske, genetiske og molekylærbiologiske forandringer i bukspyttkjertelens gangepitel kan nå studeres ut fra denne modellen (13) – (22). Da selv små (< 1 cm) svulster i bukspyttkjertelen ofte metastaserer, vil tidlig oppdagelse og behandling av forstadiene kunne være en fremtidig vei til bedret prognose for denne kreftsykdommen. I artikkelen gis en generell oversikt over PanIN som forstadier til duktalt adenokarsinom i pancreas, og vi diskuterer noen av de vanligste genetiske forandringene som her er påvist.
Klassifisering av PanIN
Bukspyttkjertelen ligger retroperitonealt. Det gjør at klinisk undersøkelse, bildediagnostisk overvåking og eventuell biopsitaking er relativt krevende, sammenliknet med undersøkelse av organer som bryst og tykktarm. Dette er en medvirkende årsak til at mange pasienter har avansert sykdom på diagnosetidspunktet. Symptomene kan være stum icterus, vekttap, nyutviklet diabetes og ryggsmerter. Begrenset diagnostisk tilgjengelighet kombinert med det raske forløpet av pancreaskreft gjør at det har vært vanskelig å følge den naturlige sykdomsutviklingen i organet fra normalt epitel via forstadier til invasiv og metastaserende kreft. Progredieringsmodeller og beskrivelse av kreftforstadier, som er kjent fra bl.a. tykktarm, cervix, prostata og endometrium, har dermed manglet for bukspyttkjertelen. Kasuistikker der pasienten var operert i bukspyttkjertelen for godartet sykdom og utviklet kreft mange år senere, la etter hvert grunnlag for forståelsen av at også når det gjelder dette organet, må det være forstadier som kan føre til kreftutvikling over tid (8, 23).
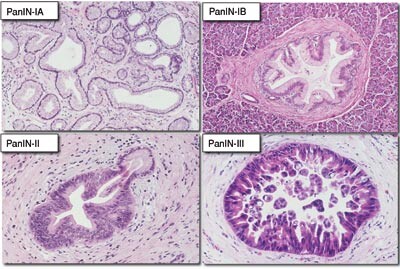
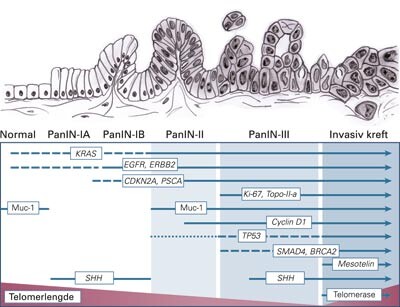
Nomenklatur for PanIN ble først foreslått i 1994 (24). Dette histologiske klassifiseringssystemet ble videreutviklet ved et konsensusmøte ved det amerikanske kreftinstituttet i 1999 (10), og den første offisielle versjonen ble publisert i 2001 (11). PanIN er nå en generelt akseptert terminologi som også er tatt inn i Verdens helseorganisasjons (WHO) beskrivelse av kreft i bukspyttkjertelen (tab 2) (2). I figur 2 gjengis typiske eksempler på PanIN-lesjoner. Et bildekartotek med eksempler på ulike typer lesjoner finnes på Internett (25). PanIN-lesjonene representerer et kontinuerlig spektrum fra tidlige neoplastiske forandringer til invasiv kreft. Figur 3 viser skjematisk hvordan gangepitelet i bukspyttkjertelen gradvis forandres som følge av endringer i molekylærbiologiske signalveier.
Tabell 2
Anbefalt terminologi for PanIN (etter WHO) (2)
| PanIN-grad |
Tidligere WHO-betegnelse |
Beskrivelse¹ |
| PanIN-IA |
Mucinøs cellehypertrofi |
Flate; kubisk epitel med basale kjerner; rikelig supranukleært mucin; ingen/lite atypi |
| PanIN-IB |
Duktal papillær hyperplasi, ev. adenomatoid duktal hyperplasi |
Som IA, men mer papillære |
| PanIN-II |
Som PanIN-IA og IB med moderat atypi |
Som IB, men med økende cytologisk kjerneatypi, tap av kjernepolaritet |
| PanIN-III |
Grov duktal atypi, carcinoma in situ |
Atypiske kjerner; gjerne kribriform vekst; tidvis mitoser og luminal nekrose |
| [i] | ||
[i] ¹ For mer detaljert beskrivelse se Hruban og medarbeidere (9, 11) samt figur 2 og figur 3
Molekylærbiologiske forandringer i PanIN
PanIN-klassifiseringen har lagt grunnlaget for kartlegging av trinnvise genetiske forandringer i bukspyttkjertelens gangepitel (19, 26) – (29) (fig 3). Utviklingsmønsteret følger de generelle kjennetegn for kreftceller, som beskrevet av Hanahan & Weinberg (30): Aktivering av onkogener, tap av tumorsuppressorgener, unngåelse av programmert celledød, ubegrenset celledeling, nydanning av blodkar og spredning ved invasjon og metastasering. Noen av disse mekanismene vil bli diskutert i den følgende beskrivelsen av progredieringsmodellen for kreft i bukspyttkjertelen.
Onkogener
Onkogener er vekstfremmende faktorer som stimulerer cellene til deling, og de synes å være tidlige aktører i kreftutviklingen. Karakteristisk for pancreascancer er at en aktiverende punktmutasjon i KRAS (K-Ras) kan påvises i om lag 90 % av tilfellene. Det er ingen andre humane svulster som fremviser en så høy andel av muterte onkogener i RAS-familien. Mutasjonene skjer tidlig i utviklingsmodellen (20) (fig 3), og frekvensen øker fra henholdsvis 36 % i PanIN-I til nærmere 90 % i PanIN-III (31). KRAS er dessuten mutert i noen tilfeller av kronisk pankreatitt, særlig etter lengre sykehistorie, noe som understreker den assosierte risiko for kreftutvikling hos denne pasientgruppen (4, 31). Overuttrykking av den vekstregulerende reseptoren ERBB2 (Her-2/neu) er også en tidlig hendelse, og finner sted i opptil 70 % av invasive svulster (15). Proliferasjonsmarkøren Ki-67 uttrykkes i økende grad i økende PanIN-stadium, som tegn på tiltakende celledelingsaktivitet.
Tumorsuppressorgener
Som motvekt til onkogenene skal normalt et panel av tumorsuppressorproteiner hindre cellen i å gå i celledeling, men de sistnevnte blir også påvirket i kreftutviklingen. Endret uttrykking av tumorsuppressorgener som CDKN2A (p16), TP53 (p53), og SMAD4 (DPC4) observeres med økende PanIN-grad samt i 40 – 70 % av invasive svulster (16, 32, 33) (fig 3). En musemodell har vist at KRAS-mutasjon utløser tidlige PanIN-forandringer, mens endringer i CDKN2A kreves for å drive cellene inn i et invasivt vekstmønster (34).
Telomerlengde og telomerase
Telomerer er repeterte DNA-sekvenser på endene av kromosomene. Lengden av telomerene forkortes vanligvis ved hver celledeling, og dette fører til at delingen stopper etter 30 – 40 cellesykluser. Telomerene fungerer som en kontrollmekanisme, et biologisk varselur som skal hindre ubegrenset celledeling. Kreftceller unnviker denne begrensningen ved aktivering av enzymet telomerase, som øker telomerlengden slik at cellen får et uendelig delingspotensial. Telomerlengden på kromosomene forkortes gradvis med økende PanIN-grad (14), noe som fører til ustabilitet i kromosomene og dermed gir økt risiko for andre genetiske forandringer. Telomerase aktiveres sent i utviklingen til invasivt karsinom.
Andre signalveier og markører
Med økende PanIN-grad ses en rekke andre molekylære forandringer. Listen inkluderer tap av BRCA2 (22), noe som sannsynligvis svekker evnen til reparasjon av DNA-skader, og overuttrykking av syklooksygenase-2 (18), som påvirker celleveksten. Videre finner man endringer i proliferasjonsmarkøren topoisomerase-II-α, glykoproteinet MUC-1 og de epiteliale markørene mesotelin og prostatastamcelleantigen (PSCA) (29, 35, 36) (fig 3). Genet SHH er essensielt for den embryonale utviklingen av bukspyttkjertelen, men er også involvert i lavgradig og høygradig PanIN (17, 26). I tillegg er det funnet mange endrede gener med ukjent funksjon (19, 26) – (29). De vanligste molekylære endringene ved utvikling av duktalt adenokarsinom i bukspyttkjertelen er vist i figur 3.
Ulike signalveier ved svulster i pancreas
Forskjeller i genaktivitet mellom ulike typer kreftsvulster i bukspyttkjertelen (tab 1) viser at duktale adenokarsinomer følger en annen biologisk utvikling enn ikke-duktale primærsvulster (28, 36). Blant annet uttrykkes ofte glykoproteinet MUC-1 som et tegn på aggressiv tumorbiologi i PanIN og duktalt adenokarsinom, mens mucinøse svulster hovedsakelig uttrykker MUC-2. Ikke-duktale pancreassvulster innehar i stor grad avvikende kjernefarging av proteinet β-catenin, mens dette fenomenet nesten ikke forekommer i duktale adenokarsinomer (28).
Klinisk-patologiske trekk ved PanIN
PanIN-lesjoner gir vanligvis ingen symptomer hos pasientene, de er ikke makroskopisk synlige, og de påvises kun ved histopatologisk undersøkelse. Den direkte kliniske betydningen av PanIN-lesjoner i bukspyttkjertelen er derfor usikker, selv om utvikling av invasiv kreft er beskrevet (23). PanIN brukes hovedsakelig som et forskningsverktøy for å subklassifisere de ulike histologiske forstadiene til kreftutvikling i pancreas.
Da PanIN-III må betraktes som carcinoma in situ (tab 2) og er vist å gi kreftresidiv hos pasienter flere år etter operasjon (23), anbefales det at slike funn tas med i patologirapporten for pancreasresektat, særlig der hvor PanIN-III ligger nær opptil eller i reseksjonsranden. Slik rutine er innført i malbeskrivelsen ved de patologiske avdelinger i Bergen og Stavanger.
PanIN-lesjoner finnes ofte utbredt i pancreasresektater for vanlig duktalt adenokarsinom, men også ved kronisk pankreatitt (som predisponerer for utvikling av kreft) samt i andre primærsvulster i bukspyttkjertelen. Spesielt bør nevnes intraduktal papillærmucinøs neoplasi (IPMN), som er en nyere definert tumorentitet på pancreasområdet. Intraduktal papillærmucinøs neoplasi har likheter og kan forveksles med PanIN-lesjoner. Definisjonene av PanIN og intraduktal papillærmucinøs neoplasi er etablert gjennom konsensus (9), og de viktigste forskjellene er gjengitt i tabell 3.
Tabell 3
Noen nyttige kjennetegn for å skille mellom PanIN og intraduktal papillærmucinøs neoplasi (IPMN). Gjengitt etter Hruban og medarbeidere (9)
| PanIN |
IPMN |
|
| Kliniske funn |
Asymptomatiske |
Tumor. Ofte kliniske funn/smerter som ved kronisk pankreatitt |
| Makroskopisk synlig? |
Nei |
Ja Dilaterte gangstrukturer |
| Størrelse |
Oftest dukter ≤ 0,5 cm |
Oftest 1 – 8 cm |
| Invasiv vekst? |
Nei |
Kan være invasive (ca. 1/3) |
| Papillær struktur |
Flate eller mikro-papillære |
Hovedsakelig papillære |
| Mucinproduserende? |
Nei |
Ja |
| Immunhistokjemi |
Ofte MUC-1-positive og MUC-2-negative |
Ofte MUC-2-positive |
Konklusjon
Bruk av molekylærbiologiske teknikker muliggjør kartlegging av den trinnvise genetiske utviklingen til ulike kreftformer. Ved kreft i bukspyttkjertelen er såkalte pankreatiske intraepiteliale neoplasier (PanIN) nå en akseptert progredieringsmodell. Videre forskning vil forhåpentligvis avdekke nye markører og kartlegge særegne genetiske egenskaper som kan bidra til forebygging, tidligere diagnose og nye behandlingsmåter for denne sykdommen (4, 26, 28).
Manuskriptet ble godkjent 8.12. 2005.
Oppgitte interessekonflikter: Ingen
- 1.
Li D, Xie K, Wolff R et al. Pancreatic cancer. Lancet 2004; 363: 1049 – 57.
- 2.
Klöppel G, Hruban R, Longnecker DS et al. Tumours of the exocrine pancreas. I: Hamilton S, Aaltonen L, red. World Health Organization Classification of Tumours. Pathology and Genetics of Tumours of the Digestive System. Lyon: IARC Press, 2000: 219 – 51.
- 3.
Bardeesy N, DePinho RA. Pancreatic cancer biology and genetics. Nat Rev Cancer 2002; 2: 897 – 909.
- 4.
Yan L, McFaul C, Howes N et al. Molecular analysis to detect pancreatic ductal adenocarcinoma in high-risk groups. Gastroenterology 2005; 128: 2124 – 30.
- 5.
Carpelan-Holmstrom M, Nordling S, Pukkala E et al. Does anyone survive pancreatic ductal adenocarcinoma? A nationwide study re-evaluating the data of the Finnish Cancer Registry. Gut 2005; 54: 385 – 7.
- 6.
Tsiotos GG, Farnell MB, Sarr MG. Are the results of pancreatectomy for pancreatic cancer improving? World J Surg 1999; 23: 913 – 9.
- 7.
Nitecki SS, Sarr MG, Colby TV et al. Long-term survival after resection for ductal adenocarcinoma of the pancreas. Is it really improving? Ann Surg 1995; 221: 59 – 66.
- 8.
Takaori K, Hruban RH, Maitra A et al. Pancreatic intraepithelial neoplasia. Pancreas 2004; 28: 257 – 62.
- 9.
Hruban RH, Takaori K, Klimstra DS et al. An illustrated consensus on the classification of pancreatic intraepithelial neoplasia and intraductal papillary mucinous neoplasms. Am J Surg Pathol 2004; 28: 977 – 87.
- 10.
Kern S, Hruban R, Hollingsworth MA et al. A white paper: the product of a pancreas cancer think tank. Cancer Res 2001; 61: 4923 – 32.
- 11.
Hruban RH, Adsay NV, Albores-Saavedra J et al. Pancreatic intraepithelial neoplasia: a new nomenclature and classification system for pancreatic duct lesions. Am J Surg Pathol 2001; 25: 579 – 86.
- 12.
Hruban RH, Goggins M, Parsons J et al. Progression model for pancreatic cancer. Clin Cancer Res 2000; 6: 2969 – 72.
- 13.
Wilentz RE, Iacobuzio-Donahue CA, Argani P et al. Loss of expression of Dpc4 in pancreatic intraepithelial neoplasia: evidence that DPC4 inactivation occurs late in neoplastic progression. Cancer Res 2000; 60: 2002 – 6.
- 14.
van Heek NT, Meeker AK, Kern SE et al. Telomere shortening is nearly universal in pancreatic intraepithelial neoplasia. Am J Pathol 2002; 161: 1541 – 7.
- 15.
Tomaszewska R, Okon K, Nowak K et al. HER-2/Neu expression as a progression marker in pancreatic intraepithelial neoplasia. Pol J Pathol 1998; 49: 83 – 92.
- 16.
Tomaszewska R, Karcz D, Stachura J. An immunohistochemical study of the expression of bcl-2 and p53 oncoproteins in pancreatic intraepithelial neoplasia and pancreatic cancer. Int J Pancreatol 1999; 26: 163 – 71.
- 17.
Thayer SP, di Magliano MP, Heiser PW et al. Hedgehog is an early and late mediator of pancreatic cancer tumorigenesis. Nature 2003; 425: 851 – 6.
- 18.
Maitra A, Ashfaq R, Gunn CR et al. Cyclooxygenase 2 expression in pancreatic adenocarcinoma and pancreatic intraepithelial neoplasia: an immunohistochemical analysis with automated cellular imaging. Am J Clin Pathol 2002; 118: 194 – 201.
- 19.
Maitra A, Adsay NV, Argani P et al. Multicomponent analysis of the pancreatic adenocarcinoma progression model using a pancreatic intraepithelial neoplasia tissue microarray. Mod Pathol 2003; 16: 902 – 12.
- 20.
Luttges J, Neumann S, Jesnowski R et al. Lack of apoptosis in PanIN-1 and PanIN-2 lesions associated with pancreatic ductal adenocarcinoma is not dependent on K-ras status. Pancreas 2003; 27: e57 – 62.
- 21.
Klein WM, Hruban RH, Klein-Szanto AJ et al. Direct correlation between proliferative activity and dysplasia in pancreatic intraepithelial neoplasia (PanIN): additional evidence for a recently proposed model of progression. Mod Pathol 2002; 15: 441 – 7.
- 22.
Goggins M, Hruban RH, Kern SE. BRCA2 is inactivated late in the development of pancreatic intraepithelial neoplasia: evidence and implications. Am J Pathol 2000; 156: 1767 – 71.
- 23.
Brat DJ, Lillemoe KD, Yeo CJ et al. Progression of pancreatic intraductal neoplasias to infiltrating adenocarcinoma of the pancreas. Am J Surg Pathol 1998; 22: 163 – 9.
- 24.
Klimstra DS, Longnecker DS. K-ras mutations in pancreatic ductal proliferative lesions. Am J Pathol 1994; 145: 1547 – 50.
- 25.
Johns Hopkins Pancreas Cancer Web: http://pathology.jhu.edu/n.web?EP=N&FL=PANCREAS_PANIN (12.10.2005).
- 26.
Prasad NB, Biankin AV, Fukushima N et al. Gene expression profiles in pancreatic intraepithelial neoplasia reflect the effects of Hedgehog signaling on pancreatic ductal epithelial cells. Cancer Res 2005; 65: 1619 – 26.
- 27.
Iacobuzio-Donahue CA, Maitra A, Shen-Ong GL et al. Discovery of novel tumor markers of pancreatic cancer using global gene expression technology. Am J Pathol 2002; 160: 1239 – 49.
- 28.
Cao D, Maitra A, Saavedra JA et al. Expression of novel markers of pancreatic ductal adenocarcinoma in pancreatic nonductal neoplasms: additional evidence of different genetic pathways. Mod Pathol 2005; 18: 752 – 61.
- 29.
Argani P, Rosty C, Reiter RE et al. Discovery of new markers of cancer through serial analysis of gene expression: prostate stem cell antigen is overexpressed in pancreatic adenocarcinoma. Cancer Res 2001; 61: 4320 – 4.
- 30.
Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 2000; 100: 57 – 70.
- 31.
Lohr M, Kloppel G, Maisonneuve P et al. Frequency of K-ras mutations in pancreatic intraductal neoplasias associated with pancreatic ductal adenocarcinoma and chronic pancreatitis: a meta-analysis. Neoplasia 2005; 7: 17 – 23.
- 32.
McCarthy DM, Brat DJ, Wilentz RE et al. Pancreatic intraepithelial neoplasia and infiltrating adenocarcinoma: analysis of progression and recurrence by DPC4 immunohistochemical labeling. Hum Pathol 2001; 32: 638 – 42.
- 33.
Hustinx SR, Leoni LM, Yeo CJ et al. Concordant loss of MTAP and p16/CDKN2A expression in pancreatic intraepithelial neoplasia: evidence of homozygous deletion in a noninvasive precursor lesion. Mod Pathol 2005; 18: 959 – 63.
- 34.
Aguirre AJ, Bardeesy N, Sinha M et al. Activated Kras and Ink4a/Arf deficiency cooperate to produce metastatic pancreatic ductal adenocarcinoma. Genes Dev 2003; 17: 3112 – 26.
- 35.
Argani P, Iacobuzio-Donahue C, Ryu B et al. Mesothelin is overexpressed in the vast majority of ductal adenocarcinomas of the pancreas: identification of a new pancreatic cancer marker by serial analysis of gene expression (SAGE). Clin Cancer Res 2001; 7: 3862 – 8.
- 36.
Adsay NV, Merati K, Andea A et al. The dichotomy in the preinvasive neoplasia to invasive carcinoma sequence in the pancreas: differential expression of MUC1 and MUC2 supports the existence of two separate pathways of carcinogenesis. Mod Pathol 2002; 15: 1087 – 95.