I svangerskapsomsorgen må leger og jordmødre som ikke har tilgang til ultralyd, bruke symfyse-fundus-mål til å estimere fostervekt og fostervekst. Et stort symfyse-fundus-mål kan være uttrykk for at fosteret er stort. Det kan også bety at det er rikelig mengde fostervann. Flerlingsvangerskap vil naturligvis føre til større symfyse-fundus-mål enn enkeltsvangerskap. Et symfyse-fundus-mål over normalområdet kan også skyldes feilmåling.
Når et symfyse-fundus-mål er over normalområdet, ser man for seg et stort barn og eventuelt en komplisert fødsel med vanskelig skulderforløsning, som kan føre til skade både på fosteret og moren.
Her setter vi søkelys på problemet sett både fra førstelinje- og annenlinjetjenesten. Vi har foretatt datasøk først og fremst ved hjelp av PubMed, som også inkluderer Medline database. Med søkeord macrosomia eg. diagnosis (symphysis-fundus estimation, ultrasound estimations), etiology, handling, cesarean section, complications, induction of labor, randomised trial, shoulder dystocia (eg. risk factors, delivery methods, birth trauma, plexus brachialis damagem, Erbs palsy (etiology and treatment). Vi vil belyse diagnose av makrosomi, etiologi til vanskelig skulderforløsning, behandling av tilstanden og aktuelle tiltak for å unngå denne fødselskomplikasjonen.
Stort barn i forhold til svangerskapsvarighet og makrosomi
Stort barn, også kalt makrosomi, kan defineres som fostervekt over 90-percentilen, fødselsvekt over 4 000 g, eventuelt fødselsvekt over 4 500 g. Fødselsvekt mer enn + 2 SD av normalvekt er en fjerde definisjon (1_3). Stort foster kan skyldes at barnet er eslet til å bli stort eller økt vekst pga. påvirkning i fosterlivet, først og fremst hos overvektige mødre, og hos gravide med stor vektøkning i svangerskapet, ved svangerskapsdiabetes og diabetes mellitus.
Makrosomi er assosiert med vanskelig fødsel, økt hyppighet av keisersnitt og post partum-blødning (1).
Symfyse-fundus-målet
Symfyse-fundus-målet registreres ved å legge et målebånd fra øvre kant av symfysen til øvre kant av uterus. Det er viktig at målebåndet skal ligge an mot huden (fig 1). Øvre kant bestemmes ved et lett press i et plan i rett vinkel fra bukveggen. Pasienten skal ligge på ryggen med strake bein. Urinblæren bør være tom (4). Symfyse-fundus-målet skal mest mulig følge fosterets lengdeakse til toppen av livmoren (5).
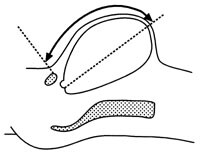
Det kliniske problemet i svangerskapsomsorgen
Ved påvisning av et symfyse-fundus-mål over normalområdet er det vanlig å henvise kvinnen til en poliklinikk for utredning. Kvinnen selv venter at problemet skal løses av legen. Hun ønsker enten få satt i gang fødselen før fosteret blir altfor stort, eller hun ber kanskje om å bli forløst med keisersnitt fordi hun er redd for at barnet kan bli skadet under fødselen. Hvordan skal lege og jordmor forholde seg til dette?
Makrosomi og vanskelig skulderforløsning
Rundt halvparten av tilfellene av skulderdystosi oppstår hos makrosome i tilslutning til fødsler med 4 000 g som makrosomigrense og rundt fjerdeparten når 4 500 g settes som grense (6 – 10). Bare 8 – 20 % av makrosome fødsler ender likevel med vanskelig skulderforløsning (11). De fleste tilfeller av skulderdystosi forekommer uten makrosomi, og de fleste makrosome fostre blir ikke utsatt for skulderdystosi (12).
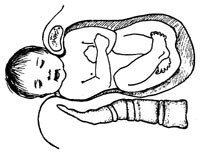
Skulderdystosi forekommer ved om lag 1 % av alle fødsler (13). Selve begrepet ”vanskelig skulderforløsning”, skulderdystosi, defineres ulikt og subjektivt (14). Tilstanden kan være dramatisk og komme uventet (14_16). Det vanligste (”normale”) er at fosteret trenger ned i bekkenet med skuldervidden i skrå eller tverrvidde. Det essensielle problemet ved skulderdystosi er at fosteret (eventuelt med unormalt stor skuldervidde) prøver å trenge ned i bekkenet i et anterioposteriørt plan. Skulderystosi kan være ensidig eller bilateral (fig 2) (17).
Stor vektøkning hos mor, overvekt, svangerskapsdiabetes, diabetes mellitus og overtidig svangerskap er risikofaktorer for makrosomi og vanskelig skulderforløsning (18). Overtid er en tilleggsrisiko (19), men en tiårig kohortstudie fra Medisinsk fødselsregister viste at overtid gav en beskjeden økning i perinatal mortalitet, og at stort barn var en beskyttende faktor (19).
Stort foster gir økt risiko for skulderdystosi, men det er vanskelig å forutse situasjonen (14). Fødselsforløpet kan gi en pekepinn. Langvarig aktiv fase av fødselen er et forvarsel, likeså at fødselen stopper helt opp. Forløsning med kopp eller tang (med hodet høyt i bekkenet) kan også ende med vanskelig skulderforløsning (20). Halvparten av tilfellene oppstår likevel uten kjente disponerende faktorer (2, 20 – 24).
Plexus brachialis-skade
Vanskelig skulderforløsning kan føre til skade på plexus brachialis og er av og til assosiert med clavicula- og humerusfraktur (25). Pleksusskade oppstår hos 10 – 30 % av barna etter skulderdystosi (13). En retrospektiv studie fra Stavanger rapporterte plexus brachialis-skade hos seks av 504 makrosome nyfødte, hos tre varte skaden i over seks måneder (26).
Historisk var den primære risikofaktor for skade av plexus brachialis at det ble øvd for kraftig drag på fremre skulder. Lesjonen har navn etter de nerverøtter som er skadet. Erbs parese, eller Duchenne-Erbs parese, er karakterisert ved skade på nerverrøttene C5, C6 og eventuelt C7. Ved Klumpkes parese er det rotskade på C8 og T1. Pleksusskade behøver likevel ikke skyldes drag på fosteret (27, 28). Varig skade på pleksus kan også forekomme etter keisersnitt og kan dessuten skyldes forhold før fødselen (29). Erbs parese kan altså forekomme uten at det har vært problem med skulderforløsning.
I de fleste tilfeller av Erbs parese er det komplett, spontan remisjon i løpet av en måneds tid (27 – 31). Behandlingstiltak ved vedvarende skade er intensiv fysikalsk behandling og elektrostimulering. Hos noen få kan mikrokirurgisk nerverekonstruksjon komme på tale (32). I 5 % av tilfellene med pleksusskade vil tilstanden vare mer enn ett år (30). Varig handikap er sjeldent (25).
Vektestimering av fosteret, diagnose av makrosomi
Primærlegen har altså symfyse-fundus-målet å stole på. Evnen til å diagnostisere avvik i fostervekt ved hjelp av dette er likevel begrenset (26, 33). Diabetes mellitus som årsak til eventuelt stort barn kan diagnostiseres ved glukosebelastning. Videre utredning skjer vanligvis ved hjelp av ultralydundersøkelse.
Det kan brukes mange sonografiske parametere for å diagnostisere endret fostervekst, ett enkelt eller en kombinasjon av mange mål. Det enkleste er å måle biparietal diameter hos fosteret og midlere abdominalomfang og bestemme fostervekt fra et nomogram. Noen måler biparietal diameter fra utside til utside av fosterhodet, andre fra utside til innside, atter andre fra innside til innside. Ved bruk av nomogram må man altså vite hvilket av de tre målene nomogrammet bygger på. Undersøkerens dyktighet spiller også en viktig rolle for resultatet, enten det er biparietal diameter eller abdominalomfanget som blir brukt for å beregne fostervekten. Andre fosterdeler kan også måles og brukes til vektestimering, slik som femurlengden og forholdet mellom femurlengden og abdominalomkretsen (34).
Den prenatale diagnose av makrosomi er vanskelig. I en publikasjon der man sammenliknet ultralydestimert fostervekt (Hadlocks formel: femurlengde og abdominalomkrets) hos flergangsfødende med morens egen vektestimering, viste det seg at kvinnens egen evaluering var like god som den sonografiske (35). Ved vektestimering med hjelp av ultralyd er det målefeil på opptil 15 % (±2 SD). Dermed vil avviket fra den aktuelle fødselsvekt kunne bli for stort til å være praktisk nyttig (36, 37). Det er hevdet at formler der man bruker kroppsmål til å beregne fostervekten blir mer nøyaktige ved bruk av tre fostermål: hodet, omfanget av abdomen og femurlengden. Da vil estimert fostervekt være innenfor 10 % av aktuell fostervekt i 85 % av tilfellene (38). Det er likevel lav spesifisitet (85 %) og dermed mange falskt positive makrosomiestimater (37). Kombinasjon av femurlengde, abdominalomkrets og biparietal diameter har en sensitivitet på 50 – 60 % i å fange opp makrosomi. Overdiagnostisering skjer hos om lag 35 % (36, 39, 40). En analyse av 13 publikasjoner fra perioden 1985 – 1995 ble tolket slik at den sonografiske vektestimering hadde en sensitivitet på ca. 60 % og en spesifisitet på ca. 90 % i å påvise stort barn (25). I en retrospektiv norsk studie av utfallet av makrosomi var fostervekten korrekt estimert hos 59 % (26).
Det er en lineær assosiasjon mellom abdominaldiameter og fostervekt. Abdominaldiameter er derfor egnet til å estimere fostervekten. Det er til og med hevdet at abdominalomfanget alene er bedre egnet til å estimere fostervekt enn kombinasjon av biparietal diameter, abdominalomfang og femurlengde (41). En studie rapporterte at stort abdominalomfang identifiserte 78 % av tilfellene av makrosomi i tredje trimester. Ved en abominalomkrets på under 36 cm var det ingen med fødselsvekt over 4 500 g (42). En annen studie viste at abdominalomkrets over 35 cm identifiserte 90 % av fostrene med vekt over 4 000 g (41).
Korrekt diagnose av makrosomi er altså et diagnostisk problem. De ulike rapportene er til dels motstridende. Det er et generelt inntrykk at vektestimering er særlig upålitelig når det dreier seg om store barn. Selv om vektestimeringen var korrekt, ville likevel den positive prediktive verdi til å spå skjebnesvanger skulderdystosi være svært lav (14).
Svangerskapsdiabetes og diabetes mellitus
En av årsakene til makrosomi er diabetes mellitus og svangerskapsdiabetes (2, 43 – 46). Mødre med diabetes risikerer å få store barn, avhengig av hvor godt tilstanden er regulert. Ved diabetes mellitus er om lag 10 % av alle fødsler assosiert med skulderdystosi og ved makrosomi hos diabetikere 25 – 50 % (47). I diabetikersvangerskap er vektestimeringen mindre nøyaktig enn hos ikke-diabetikere. Ved asymmetri hos fosteret hos diabetiske mødre har vanlig brukte formler begrenset verdi for å påvise store fostre (48). Det er rapportert at formler som bruker mål av hode, abdomen og femur har 95 % konfidensintervall på ± 24 %, mot ± 15 % hos ikke-diabetikere (49). Ved å bruke en konvensjonell formel var det 77 % risiko for makrosomi ved estimert fødselsvekt over 4 000 g i diabetessvangerskap og 86 % ved estimert fostervekt over 4 500 g (11, 49). Asymmetri hos fosteret til diabetespasienter kan beregnes ved differansen i centimeter mellom abdominaldiameter og biparietaldiameter. Man har funnet at denne differansen korrelerer med insidensen av skulderdystosi (50). Dette avspeiles i en databankstudie der stor abodminalomkrets blir brukt sammen med femurlengde og hodeomkrets (Hadlocks formel) for å estimere fosterets vekt. Ved å ta hensyn til morens høyde, vekt og om hun har diabetes mellitus i tillegg kunne diagostikken av makrosmi bedres. Datamaskinen regner ut vekten på grunnlag formlene bak. Nytteverdien av dette nye systemet er ikke bekreftet i prospektiv studie (51).
God svangerskapsomsorg som gir lavt blodsukkernivå hos diabetikere, reduserer frekvensen av makrosomi (52). Streng regulering av blodsukkernivået kombinert med induksjon av fødsel ved 38. – 39. svangerskapsuke og forløsning med keisersnitt ved antatt fødselsvekt over 4 000 g reduserer frekvensen av skulderdystosi ved svangerskapsdiabetes (45, 46). I en prospektiv studie fra Texas og i en studie fra Israel ble det tilrådd keisersnitt ved estimert fødselsvekt over 4 250 g (47, 52).
Tiltak for å redusere fødselsproblemer er:
– God blodsukkerregulering for å redusere hyppighet av makrosomi.
– Eventuelt å indusere fødsel hos gravide diabetikere når makrosomi er mistenkt.
– Forløse mødre med makrosome fostre med keisersnitt (17, 20, 47). Ved estimert fostervekt over 4 000 g er det hos diabetikere rimelig å overveie elektivt keisersnitt (45, 46).
Fødselsinduksjon for å unngå vanskelig skulderforløsning
Fødselsinduksjon kan føre til økning i antall keisersnitt uten at det blir færre tilfeller av skulderdystosi (53 – 55). Skulderdystosi er sjeldnere om fødselen starter spontant enn om den blir indusert (56). Ved estimert fostervekt over 4 200 g ble det i en rapport fra Israel frarådd både vektestimering og fødselsinduksjon (57). Randomiserte studier omkring mistanke om stort foster tyder ikke på at fødselsinduksjon reduserer risikoen for mor eller barn. Fødselsinduksjon løser dermed ikke problemet med skulderdystosi hos ikke-diabetikere (17, 36, 58). Også andre studier taler imot fødselsinduksjon (17, 53, 57). Det beste er altså om fødselen starter spontant.
Forløsning med keisersnitt for å forhindre fødselsproblemer
Keisersnitt gir ulike komplikasjoner, som blødning, infeksjon og trombose. Det er også ofte lavere apgarpoeng ved forløsning av makrosome med keisersnitt enn ved vaginalforløsning (59). Det er videre rapportert mindre behov for overføring til neonatalavdeling etter vaginalforløsning (2,1 %) enn ved forløsning med keisersnitt (6,0 %) (60). En studie rapporterte verken asfyksi, perinatal mortalitet eller permanent skade etter vaginalførløsning av makrosome med vekt 4 500 g (61). Det er til og med rapportert større neonatal mortalitet og morbiditet ved forløsning av makrosome med keisersnitt enn ved vaginalforløsning (60). Dette er likevel ikke et entydig funn (62).
Det er sammenheng mellom fødselsvekt og pleksusskade ved vanskelig skulderforløsning. I en studie av 504 gravide med barn med fødselsvekt over 4 200 g ble utfallet analysert i forhold til om makrosomi var påvist med ultralyd før fødselen eller ikke. Keisersnitt ble utført ved mislykket fødselsinduksjon. Det var ikke forskjell i hyppighet av skulderdystosi eller fødselsskade i de to gruppene (57). Ulike studier viser at det må til et stort antall keisersnitt, fra 148 til 2 345, for at ett enkelt tilfelle av Erbs parese pga. skulderdystosi skal kunne unngås (25, 63, 64). Selv ved antatt fødselsvekt over 5 000 g blir det ikke generelt tilrådd keisersnitt (65). Andre setter søkelyset på de store økonomiske kostnadene og det store antall keisersnitt som må til for å forhindre skulderdystosi. Dette taler for at keisersnitt ikke er den beste metoden for forløsning av mødre til makrosome fostre (12). Elektivt keisersnitt bør etter dette ikke være rutine for å forhindre fødselsskade der det er mistanke om stort barn (66). En rapport fra Danmark tilrår keisersnitt ved antatt fødselsvekt over 5 000 g (67). Også andre tilrår keisersnitt ved estimert fødselsvekt over 5 000 g (35, 44). Det er derfor rimelig å gå inn for elektivt keisersnitt ved estimert fødselsvekt over 5 000 g.
Forslag til opplegg
Uten tilleggsindikasjon er det ikke solide data for å indusere fødsel eller forløse ikke-diabetikere med keisersnitt ved mistanke om stort barn. En del av dem som får fødselen fremkalt, vil få ulike unødvendige og uønskede komplikasjoner som følge av eventuelt keisersnitt. Den gravide bør informeres om dette. Det beste er derfor om hun velger å vente på spontan fødsel eller at fødsel induseres ved overtid. Ved estimert fostervekt 5 000 g bør keisersnitt overveies. Det oppstår dessuten sjeldnere fødselsproblemer ved vanskelig skulderforløsning om fødselen starter spontant enn om den blir indusert. Om hun pga. angst vil ha svangerskapet avsluttet med fødselsinduksjon eller keisersnitt, bør det overveies å innfri hennes ønske.
Tiltak ved diabetes
Begrensede data fra én enkelt randomisert studie av svangerskapsdiabetes behandlet med insulin tydet på at fødselsinduksjon reduserte risikoen for makrosomi. Etter Cochrane-databasen er det ikke solide data som støtter elektiv forløsning (induksjon eller elektivt keisersnitt) eller ekspekterende behandling ved termin kvinner med insulintrengende diabetes mellitus (68). Dersom kvinnen har diabetes mellitus og det er mistanke om stort barn, kan det likevel overveies å indusere fødsel ved 38. – 39. svangerskapsuke og å forløse med keisersnitt ved estimert fostervekt over 4 000 g (45, 46).
Strategi ved vanskelig skulderforløsning
Man kan altså ikke unngå vanskelig skulderforløsning (13). Jordmor og lege får plutselig og av og til uventet et problem som i verste fall kan føre til at barnet dør under fødselen eller blir varig skadet. Når vanskelig skulderforløsning oppstår, bør man derfor ha en strategi før forløsningen (69). Dersom skuldrene ikke kan hjelpes frem ved innøvd teknikk ved å senke og løfte fosterhodet og jordmor får mistanke om at skuldrene står fast, kan det øves et trykk ovenfor symfysen for å presse fremre skulder ned slik at den kan trenge ned i bekkenet. Fundustrykk kan være uheldig (18).
Det er viktig at det ikke dras for sterkt i hodet før skulderforløsningen. For kraftig drag kan være årsak til pleksusskade. God episiotomi er nødvendig (18). Ved Kvinneklinikken i Bergen har det vært innøvd en metode fra Løvsets tid som eldre jordmødre og leger er fortrolig med. Fødselshjelperen fører hånden ned langs ryggen til barnet og oppsøker bakre aksillarfold. Ved et kraftig drag roteres skulderen slik at den kan skrus fortil slik at kvinnen kan forløses (70).
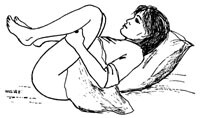
En annen metode er McRoberts manøver, som ble omtalt allerede i 1899 (17). McRoberts manøver utføres med maksimal fleksjon i hofte og kneledd (fig 3): Lårene presses opp mot abdomen, og det øves et suprapubisk trykk av en hjelper for å få skulderen til å rotere i retning av fosterets ansikt (13). McRoberts manøver bidrar til større utgangsåpning og mindre fødselshindring av promotorium. Ved at fosteret bøyes til siden, vil bakre skulder kunne trenge ned slik at kvinnen kan forløses (18). Tillegg til McRoberts manøver er rotasjon ved hjelp av Woods skruemanøver eller Robins modifikasjon (18). Andre metoder som står til disposisjon er Zavanellis manøver (18, 20, 71, 72) og symfysiotomi (73). Ved Zavanellis manøver skyves fosterhodet opp i bekkenet slik at barnet kan tas med keisersnitt (20, 71, 72). Etter litteraturen å dømme er denne prosedyren ofte vellykket. Symfysiotomi kan utføres i lokalanestesi (73). Huden infiltreres med lokalanestesi, som også settes inn i symfysen. Med en hånd i vagina skyves urethra til høyre og det legges et snitt inn i symfysen transvaginalt. Når forløseren kjenner nedenfra og snitter samtidig, kan dybden kontrolleres. Dersom Zavanellis manøver mislykkes, kan symfysiotomi være et effektivt og livreddende alternativ (31, 46, 47, 55, 65, 73, 74). Symfysiotomi er også nevnt i den norske Veileder i fødselshjelp, men vi kjenner ikke til at det har vært utført her i landet (69).
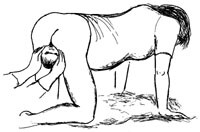
Enkelte jordmødre har øvd inn et opplegg som går utpå at den fødende bringes over på alle fire (kne-hånd-leie), dermed kan kvinnen eventuelt forløses (fig 4). Denne metoden lærte en jordmor i 1976 da hun var på besøk i Guatemala (75).
– Stort symfyse-fundus-mål gir mistanke om stort barn, rikelig mengde fostervann, eventuelt flerlingsvangerskap
– Makrosomi defineres ulikt: som vekt over 90-percentilen, eller over + 2 SD, eventuelt fødselsvekt 4 000 g eller 4 500 g
– Risikofaktorer for vanskelig skulderforløsning er diabetes hos mor, stort barn, lang aktiv fase av fødselen eller full stopp i fødselen, lang utdrivningstid, forløsning med kopp eller tang med hodet midt i bekkenet
– God svangerskapsomsorg og velregulert diabetes motvirker tilstanden
– Vektestimering av fosteret er usikkert, både med symfyse-fundus-mål og ultralyd. Abdominalomfanget er viktigste enkeltmål
– Det er sjeldnere vanskelig skulderforløsning om fødselen starter spontant i makrosome svangerskap enn om fødselen induseres
– Selv med antatt fostervekt 4 000 g, 4 500 g er det ikke indikasjon for induksjon av fødsel eller forløsning med keisersnitt hos ikke-diabetikere
– Ved antatt fostervekt 5 000 g og mer bør man overveie keisersnitt
– Vanskelig skulderforløsning kan ikke unngås totalt, derfor må man kjenne måter å løse problemet på:
God episiotomi
Øve trykk ovenfor symfysen for å presse ned fremre skulder
McRoberts manøver
Eventuelt:
Løvsets metode til vanskelig skulderforløsning
eller
Bringe den fødende over på alle fire (kne-hånd)
Zavanellis manøver (skyve opp fosterhodet og forløse med keisersnitt)
eller
Symfysiotomi i lokalanestesi
- 1.
Gonen R, Spiegel D, Abend M. Is macrosomia predictable, and are shoulder dystocia and birth trauma preventable? Obstet Gynecol 1996; 88: 526 – 9.
- 2.
Persson B, Hanson U. Neonatal morbidities in gestational diabetes mellitus. Diabetes Care 1998; 21 (suppl 2): B79 – B84.
- 3.
Schwartz R, Teramo KA. What is the significance of macrosomia? Diabetes Care 1999; 22: 1201 – 5.
- 4.
Persson B, Stangenberg M, Lunell NO, Brodin U, Holmberg NG, Vaclavinkova V. Prediction of size of infants at birth by measurement of symphysis fundus height. Br J Obstet Gynaecol 1986; 93: 206 – 11.
- 5.
Kiserud T, Servoll T. Symfyse-fundusmåling som ledd i svangerskapskontrollen. Tidsskr Nor Lægeforen 1982; 102: 243 – 5.
- 6.
Acker DB, Sachs BP, Friedman EA. Risk factors for shoulder dystocia. Obstet Gynecol 1985; 66: 762 – 8.
- 7.
Baskett TF, Allen AC. Perinatal implications of shoulder dystocia. Obstet Gynecol 1995; 86: 14 – 7.
- 8.
Mikulandra F, Perisa M, Stojnic E. When is fetal macrosomia (>or = 4500 g) an indication for caesarean section? Zentralbl Gynakol 1996; 118: 441 – 7.
- 9.
Modanlou HD, Dorchester WL, Thorosian A, Freeman RK. Macrosomia – maternal, fetal, and neonatal implications. Obstet Gynecol 1980; 55: 420 – 4.
- 10.
Sandmire HF, O’Halloin TJ. Shoulder dystocia: its incidence and associated risk factors. Int J Gynaecol Obstet 1988; 26: 65 – 73.
- 11.
Fetal macrosomia. ACOG Technical Bulletin Number 159–September 1991. Int J Gynaecol Obstet 1992; 39: 341 – 5.
- 12.
Sandmire HF, Woolley RJ. Macrosomia: can we prevent big problems with big babies? Birth 1998; 25: 263 – 7.
- 13.
Lange AP. Fødsel af store børn. Ugeskr Læger 1998; 160: 1295.
- 14.
Hope P, Breslin S, Lamont L, Lucas A, Martin D, Moore I et al. Fatal shoulder dystocia: a review of 56 cases reported to the Confidential Enquiry into Stillbirths and Deaths in Infancy. Br J Obstet Gynaecol 1998; 105: 1256 – 61.
- 15.
Hart G. Waiting for shoulders. Midwifery Today Childbirth Educ Summer 1997; nr. 42: 32 – 4.
- 16.
Lewis DF, Edwards MS, Asrat T, Adair CD, Brooks G, London S. Can shoulder dystocia be predicted? Preconceptive and prenatal factors. J 33.Reprod Med 1998; 43: 654 – 8.
- 17.
Johnstone FD, Myerscough PR. Shoulder dystocia. Br J Obstet Gynaecol 1998; 105: 811 – 5.
- 18.
O’Leary JA. Shoulder dystocia: prevention and treatment. I: Iffy L, Apuzzio JJ, Vintzileos AM, red. Operative obstetrics. 2. utg. New York: McGraw-Hill, 1992: 234 – 43.
- 19.
Campbell MK, Ostbye T, Irgens LM. Post-term birth: risk factors and outcomes in a 10-year cohort of Norwegian births. Obstet Gynecol 1997; 89: 543 – 8.
- 20.
O’Leary JA. Cephalic replacement for shoulder dystocia: present status and future role of the Zavanelli maneuver. Obstet Gynecol 1993; 82: 847 – 50.
- 21.
Bennett BB. Shoulder dystocia: an obstetric emergency. Obstet Gynecol Clin North Am 1999; 26: 445 – 58.
- 22.
Gherman RB, Goodwin TM. Shoulder dystocia. Curr Opin Obstet Gynecol 1998; 10: 459 – 63.
- 23.
Gherman RB, Ouzounian JG, Miller DA, Kwok L, Goodwin TM. Spontaneous vaginal delivery: a risk factor for Erb’s palsy? Am J Obstet Gynecol 1998; 178: 423 – 7.
- 24.
Gherman RB, Ouzounian JG, Goodwin TM. Brachial plexus palsy: an in utero injury? Am J Obstet Gynecol 1999; 180: 1303 – 7.
- 25.
Rouse DJ, Owen J, Goldenberg RL, Cliver SP. The effectiveness and costs of elective cesarean delivery for fetal macrosomia diagnosed by ultrasound. JAMA 1996; 276: 1480 – 6.
- 26.
Wojtasinska M, Belfrage P, Gjessing L. Stort foster – en retrospektiv studie Tidsskr Nor Lægeforen 2000; 120: 1848 – 50.
- 27.
Dodds SD, Wolfe SW, Hoffer MM. Perinatal brachial plexus palsy. The shoulder in neonatal brachial palsy. Curr Opin Pediatr 2000; 12: 40 – 7.
- 28.
Ouzounian JG, Korst LM, Phelan JP. Permanent Erb palsy: a traction-related injury? Obstet Gynecol 1997; 89: 139 – 41.
- 29.
Ouzounian JG, Korst LM, Phelan JP. Permanent Erb’s palsy: a lack of a relationship with obstetrical risk factors. Am J Perinatol 1998; 15: 221 – 3.
- 30.
Gordon M, Rich H, Deutschberger J, Green M. The immediate and long-term outcome of obstetric birth trauma. I. Brachial plexus paralysis. Am J Obstet Gynecol 1973; 117: 51 – 6.
- 31.
Peleg D, Hasnin J, Shalev E. Fractured clavicle and Erb’s palsy unrelated to birth trauma. Am J Obstet Gynecol 1997; 177: 1038 – 40.
- 32.
Terzis JK, Papakonstantinou KC. Management of obstetric brachial plexus palsy. Hand Clin 1999; 15: 717 – 36.
- 33.
Wikstrom I, Bergstrom R, Bakketeig L, Jacobsen G, Lindmark G. Prediction of high birthweight from maternal characteristics, symphysis fundal height and ultrasound biometry. Gynecol Obstet Invest 1993; 35: 27 – 33.
- 34.
Hadlock FP, Harrist RB, Fearneyhough TC, Deter RL, Park SK, Rossavik IK. Use of femur length/abdominal circumference ratio in detecting the macrosomic fetus. Radiology 1985; 154: 503 – 5.
- 35.
Question of the quarter. What is the worst case of shoulder dystocia you’ve ever encountered, and what was the outcome? Midwifery Today Int Midwife 1999; 8: 14.
- 36.
Gonen O, Rosen DJ, Dolfin Z, Tepper R, Markov S, Fejgin MD. Induction of labor versus expectant management in macrosomia: a randomized study. Obstet Gynecol 1997; 89: 913 – 7.
- 37.
Hadlock FP, Harrist RB, Sharman RS, Deter RL, Park SK. Estimation of fetal weight with the use of head, body, and femur measurements – a prospective study. Am J Obstet Gynecol 1985; 151: 333 – 7.
- 38.
Reece EA, Hagay Z. Prenatal diagnosis of deviant fetal growth. I: Reece EA, Hobbins J, red. Medicine of the fetus and the mother. 2. utg. Philadelphia: Lippincott Raven, 1999: 709 – 23.
- 39.
Beer E, Folghera MG. Time for resolving shoulder dystocia. Am J Obstet Gynecol 1998; 179: 1376 – 7.
- 40.
Levine AB, Lockwood CJ, Brown B, Lapinski R, Berkowitz RL. Sonographic diagnosis of the large for gestational age fetus at term: does it make a difference? Obstet Gynecol 1992; 79: 55 – 8.
- 41.
Smith GC, Smith MF, McNay MB, Fleming JE. The relation between fetal abdominal circumference and birthweight: findings in 3512 pregnancies. Br J Obstet Gynaecol 1997; 104: 186 – 90.
- 42.
Tamura RK, Sabbagha RE, Depp R, Dooley SL, Socol ML. Diabetic macrosomia: accuracy of third trimester ultrasound. Obstet Gynecol 1986; 67: 828 – 32.
- 43.
Adams KM, Li H, Nelson RL, Ogburn PL jr., Danilenko-Dixon DR. Sequelae of unrecognized gestational diabetes. Am J Obstet Gynecol 1998; 178: 1321 – 32.
- 44.
Berard J, Dufour P, Vinatier D, Subtil D, Vanderstichele S, Monnier JC et al. Fetal macrosomia: risk factors and outcome. A study of the outcome concerning 100 cases> 4500 g. Eur J Obstet Gynecol Reprod Biol 1998; 77: 51 – 9.
- 45.
Hod M, Bar J, Peled Y, Fried S, Katz I, Itzhak M et al. Antepartum management protocol. Timing and mode of delivery in gestational diabetes. Diabetes Care 1998; 21 (suppl 2): B113 – B7.
- 46.
Lurie S, Insler V, Hagay ZJ. Induction of labor at 38 to 39 weeks of gestation reduces the incidence of shoulder dystocia in gestational diabetic patients class A2. Am J Perinatol 1996; 13: 293 – 6.
- 47.
Conway DL, Langer O. Elective delivery of infants with macrosomia in diabetic women: reduced shoulder dystocia versus increased cesarean deliveries. Am J Obstet Gynecol 1998; 178: 922 – 5.
- 48.
Landon MB. Prenatal diagnosis of macrosomia in pregnancy complicated by diabetes mellitus. J Matern Fetal Med 2000; 9: 52 – 4.
- 49.
Benson CB, Doubilet PM, Saltzman DH. Sonographic determination of fetal weights in diabetic pregnancies. Am J Obstet Gynecol 1987; 156: 441 – 4.
- 50.
Cohen BF, Penning S, Ansley D, Porto M, Garite T. The incidence and severity of shoulder dystocia correlates with a sonographic measurement of asymmetry in patients with diabetes. Am J Perinatol 1999; 16: 197 – 201.
- 51.
Sokol RJ, Chik L, Dombrowski MP, Zador IE. Correctly identifying the macrosomic fetus: improving ultrasonography-based prediction. Am J Obstet Gynecol 2000; 182: 1489 – 95.
- 52.
Wiznitzer A. Obstructed labor and shoulder dystocia. Curr Opin Obstet Gynecol 1995; 7: 486 – 91.
- 53.
Combs CA, Singh NB, Khoury JC. Elective induction versus spontaneous labor after sonographic diagnosis of fetal macrosomia. Obstet Gynecol 1993; 81: 492 – 6.
- 54.
Leaphart WL, Meyer MC, Capeless EL. Labor induction with a prenatal diagnosis of fetal macrosomia. J Matern Fetal Med 1997; 6: 99 – 102.
- 55.
Nesbitt TS, Gilbert WM, Herrchen B. Shoulder dystocia and associated risk factors with macrosomic infants born in California. Am J Obstet Gynecol 1998; 179: 476 – 80.
- 56.
Jazayeri A, Heffron JA, Phillips R, Spellacy WN. Macrosomia prediction using ultrasound fetal abdominal circumference of 35 centimeters or more. Obstet Gynecol 1999; 93: 523 – 6.
- 57.
Weeks JW, Pitman T, Spinnato JA. Fetal macrosomia: does antenatal prediction affect delivery route and birth outcome? Am J Obstet Gynecol 1995; 173: 1215 – 9.
- 58.
Irion O, Boulvain M. Induction of labour for suspected fetal macrosomia. Cochrane Database Syst Rev 2000; 2:CD000938: CD000938
- 59.
Sarno AP jr., Hinderstein WN, Staiano RA. Fetal macrosomia in a military hospital: incidence, risk factors, and outcome. Mil Med 1991; 156: 55 – 8.
- 60.
Sandmire HF, DeMott RK. The Green Bay cesarean section study. IV. The physician factor as a determinant of cesarean birth rates for the large fetus. Am J Obstet Gynecol 1996; 174: 1557 – 64.
- 61.
Lipscomb KR, Gregory K, Shaw K. The outcome of macrosomic infants weighing at least 4500 grams: Los Angeles County + University of Southern California experience. Obstet Gynecol 1995; 85: 558 – 64.
- 62.
Bleichenbacher M, Haenel AF. Das perinatale Risiko bei erheblicher Makrosomie. Untersuchung aufgrund der Databank der Arbeitsgemeinschaft Schweizerischen Frauenkliniken (ASF). Geburtshilfe Frauenheilkd 1995; 55: 339 – 44.
- 63.
Bryant DR, Leonardi MR, Landwehr JB, Bottoms SF. Limited usefulness of fetal weight in predicting neonatal brachial plexus injury. Am J Obstet Gynecol 1998; 179: 686 – 9.
- 64.
Kolderup LB, Laros RK jr., Musci TJ. Incidence of persistent birth injury in macrosomic infants: association with mode of delivery. Am J Obstet Gynecol 1997; 177: 37 – 41.
- 65.
Linnet KM, Jensen H, Rasmussen KL. Fødsel af ekstremt store børn. Ugeskr Læger 1998; 160: 1312 – 4.
- 66.
Ecker JL, Greenberg JA, Norwitz ER, Nadel AS, Repke JT. Birth weight as a predictor of brachial plexus injury. Obstet Gynecol 1997; 89: 643 – 7.
- 67.
Rasmussen BR, Mosgaard KE. Makrosomi. Diagnosticering, fødsel og komplikationer. Ugeskr Læger 1993; 155: 3185 – 90.
- 68.
Boulvain M, Stan C, Irion O. Elective delivery in diabetic pregnant women. Cochrane Database Syst Rev 2000; 2:CD001997: CD001997.
- 69.
Berge LN, Johansen ED, Valbø A. Skulderdystosi. I: Dalaker K, Nøstdahl W, Nilsen ST, Løvset T, Jerve F, red. Veileder i fødselshjelp 1998. Oslo: Den norske lægeforening, 1998: 141 – 3.
- 70.
Løvset J. Methods of delivery of the shouldeers in vertex deliveries. I: Løvset J, red. Vaginal operative delivery. 1. utg. Oslo: Universitetsforlaget, 1968: 106 – 8.
- 71.
Iffy L, Ganesh V, Gittens L. Obstetric maneuvers for shoulder dystocia. Am J Obstet Gynecol 1998; 179: 1379 – 80.
- 72.
Sandberg EC. The Zavanelli maneuver: 12 years of recorded experience. Obstet Gynecol 1999; 93: 312 – 7.
- 73.
Goodwin TM, Banks E, Millar LK, Phelan JP. Catastrophic shoulder dystocia and emergency symphysiotomy. Am J Obstet Gynecol 1997; 177: 463 – 4.
- 74.
Spellacy WN. Erb’s palsy without shoulder dystocia. Am J Obstet Gynecol 1998; 179: 561 – 2.
- 75.
Meenan AL, Gaskin IM, Hunt P, Ball CA. A new (old) maneuver for the management of shoulder dystocia. J Fam Pract 1991; 32: 625 – 9._