En tidligere frisk mann utviklet gradvis innsettende kraft-, og følelsesløshet i beina, forenlig med polynevropati. Årsaken var en sannsynligvis underdiagnostisert tilstand som er viktig å huske på siden den responderer på behandling.
En tidligere frisk mann i 70-årene ble akuttinnlagt ved sitt lokalsykehus med to ukers sykehistorie preget av raskt innsettende ryggsmerter med utstråling til beina, hvor han også merket nummenhet og kraftsvikt. Ved innleggelsen var det kraftsvekkelse sidelikt proksimalt og distalt i begge underekstremitetene, utslukkede patella- og akillesreflekser, samt redusert sensibilitet for alle sansekvaliteter distalt i underekstremitetene. Han hadde i sykdomsforløpet også fått symptomer på autonom svikt med ortostatisk blodtrykksfall, munntørrhet og obstipasjon.
Korsryggsmerter er svært vanlig i befolkningen og en hyppig årsak til tap av livskvalitet (1). Studier har vist at nær 1 % av alle innleggelser i sykehus er knyttet opp mot tilstanden (2). Isjialgi er en betegnelse på smerteutstråling fra korsryggen nedover låret, og eventuelt videre ut i foten. Det er assosiert med irritasjon av isjiasnerven (L4–S3), eksempelvis sekundært til skiveprolaps, foraminal beinavleiring og andre strukturelle prosesser i relasjon til spinale nerverøtter. Det kan også skyldes andre forhold, både nevropatiske, som inflammatoriske radikulitter, og ikke-nevropatiske, som aortaaneurisme, piriformissyndrom og smerter fra hofteledd og bevegelsesapparat for øvrig (3). Funn som krever rask nevroradiologisk avklaring, inkluderer paraparese med utslukkede dype senereflekser, hypoestesi i perineum, redusert sfinktertonus og blæreparese. Dette er funn som blant annet kan sees ved større midtstilte prolapser med avklemming av flere nerverøtter, såkalt cauda equina-syndrom.
Siden pasienten hadde symptomer på isjialgi, ble det initialt utført MR av columna. Denne viste ingen patologi. Sammenfattet var sykehistorien og de kliniske funn imidlertid forenlig med en progressiv motorisk og sensorisk polynevropati. Videre utredning med spinalpunksjon viste forhøyet totalprotein (1,35 g/L, normalt < 0,50 g/L) med normalt celletall, mens nevrografi og elektromyografi viste forlenget latens, reduserte amplituder og tegn til akutt denervasjon. Samlet sett ble tilstanden vurdert som best forenlig med akutt motorisk-sensorisk aksonal nevropati, som er en undergruppe av Guillain-Barrés syndrom. Pasienten ble derfor behandlet med intravenøs immunglobulin G 2 g/kg over fem dager, og han ble skrevet ut få dager senere klinisk stabil og mobilisert med prekestol.
Ved progredierende svekkelse av muskelkraft, svekkede dype senereflekser og/eller redusert sensibilitet bør inflammatorisk polyradikulonevropati vurderes som differensialdiagnose. Guillain-Barrés syndrom og kronisk inflammatorisk demyeliniserende polynevropati er de vanligste formene, hver med sine undergrupper. Guillain-Barrés syndrom oppstår typisk akutt eller subakutt, oftest i etterkant av infeksjon med symptomprogresjon i løpet av fire uker (4). Ved kronisk inflammatorisk demyeliniserende polynevropati forventes på den annen side symptomprogresjon utover åtte uker, selv ved akutt eller subakutt start hvor den initiale sykdomsutviklingen kan være like dramatisk som ved Guillain-Barrés syndrom. Kliniske kjennetegn inkluderer lavere forekomst av autonom og respiratorisk svikt samt redusert forekomst av hjernenerveutfall ved kronisk inflammatorisk demyeliniserende polynevropati (5). Nevrofysiologiske funn er diagnostisk obligat ved kronisk inflammatorisk demyeliniserende polynevropati, men ikke ved Guillain-Barrés syndrom. Funn av forhøyet totalprotein i spinalvæsken støtter begge diagnosene, men er imidlertid ikke nødvendig for å sette diagnose. Begge tilstandene kan behandles med intravenøs immunglobulin G, generelt med god respons (6).
Etter utskrivelse ble pasienten på nytt gradvis verre, med økende pareser og følelsesløshet i beina. Av usikker årsak ble ikke pasienten vurdert på nytt før det var gått over to måneder etter første innleggelse. Han var da ikke i stand til å gå selv med hjelpemidler, og måtte støttes av personalet ved mobilisering. Klinisk undersøkelse viste tiltagende pareser og hypoestesi i beina. Ny nevrofysiologisk undersøkelse viste som tidligere forlengede distale latenser, men det ble nå påvist konduksjonsblokk som er mest forenlig med primær demyeliniserende polynevropati. Som ledd i utvidet utredning, ble det utført CT-undersøkelse av toraks, abdomen og bekken med tanke på eventuell underliggende malignitet, uten funn av aktuell patologi. Det ble også tatt blodprøver med analyse av paraneoplastiske antistoffer, gangliosidantistoffer og proteinelektroforese, alle med normale funn. På bakgrunn av den kliniske utviklingen og nevrofysiologiske funn, ble kronisk inflammatorisk demyeliniserende polynevropati vurdert som den mest sannsynlige diagnosen fremfor Guillain-Barrés syndrom siden man så fortsatt klinisk progresjon utover fire uker.
Ved raskt progredierende nevropatier og diagnostisk usikkerhet bør man vurdere et bredere differensialdiagnostisk spektrum. Dette inkluderer både systemiske inflammatoriske tilstander, som sarkoidose og vaskulitter, infeksjoner, som nevroborreliose, samt paraproteinemisk sykdom og paramaligne tilstander (7, 8). Hos vår pasient ble kronisk inflammatorisk demyeliniserende polynevropati vurdert som den mest sannsynlige differensialdiagnosen. Ved kronisk inflammatorisk demyeliniserende polynevropati vil det, i motsetning til ved Guillain-Barrés syndrom, være aktuelt med immunmodulerende behandling over lengre tid. Den europeiske nevrologiforeningen anbefaler i sine retningslinjer for kronisk inflammatorisk demyeliniserende polynevropati behandling basert på enten gjentatte kurer med intravenøst immunglobulin G eller kortikosteroider (9).
Behandlingsopplegget individualiseres, med forsøk på nedtrapping etter klinisk status. Plasmaferese kan forsøkes ved behandlingssvikt, mens andre immunmodulerende medikamenter har dårligere dokumentert effekt.
Litt over to måneder etter første innleggelse startet pasienten månedlige behandlinger med intravenøst immunglobulin G (2 g/kg over fem dager). På tross av denne behandlingen progredierte tilstanden over de tre neste månedene, hvor det tilkom BiPAP-krevende respiratoriske besvær i form av svekket hostekraft og redusert forsert vitalkapasitet (50 %), samt tegn til hjernenerveaffeksjon med svakhet i ansiktsmuskulatur.
Manglende klinisk respons på gjentatte kurer med intravenøst immunglobulin G, tidligere autonom svikt, samt nytilkommet respirasjonssvikt og hjernenerveaffeksjon, talte for at det kunne foreligge en distinkt undergruppe av kronisk inflammatorisk demyeliniserende polynevropati. Ved et slikt atypisk forløp med behandlingssvikt anbefales det i europeiske retningslinjer å utføre en supplerende serologisk utredning med analyse av antistoffer mot nodale og paranodale proteiner (9).
Det ble derfor, seks måneder etter første innleggelse, tatt nye blodprøver med spesifikt ønske om analyse av nodale og paranodale antistoffer, og det ble påvist antistoffer mot Contactin-1-assosiert protein (Caspr1) (figur 1). Det ble startet behandling med rituksimab, og ved kontroll to måneder etter oppstart var det bedring av både kraftprestasjoner og respirasjon.
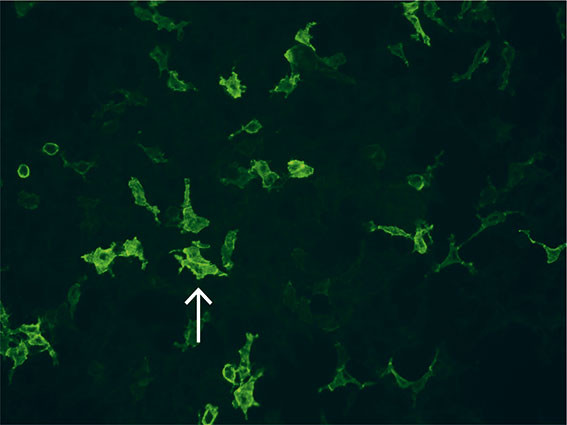
Diskusjon
Felles for både Guillain-Barrés syndrom og kronisk inflammatorisk demyeliniserende polynevropati er vesentlig god effekt av intravenøst immunglobulin G. Samtidig har man sett en undergruppe pasienter, totalt 2–15 % ved Guillain-Barrés syndrom eller kronisk inflammatorisk demyeliniserende polynevropati, hvor slik behandlingsrespons har uteblitt (10, 11). Man har i denne pasientpopulasjonen påvist antistoffer mot ulike antigener i det nodale, paranodale og juxtaparanodale området (figur 2). Disse områdene består i de perifere myeliniserte nervene av Ranviers node, som ikke er myelinkledd, og de direkte tilsluttede områdene hvor myelinet fester seg til nerven.
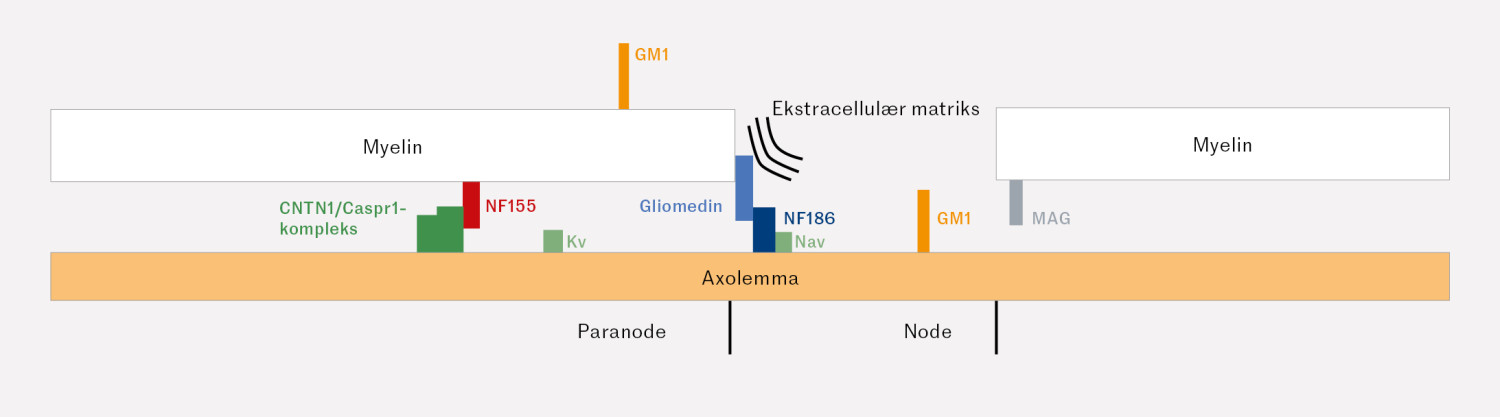
Det finnes ulike varianter av kronisk inflammatorisk demyeliniserende polynevropati, og ved enkelte av disse kan det påvises antistoffer som er rettet mot nodo- og paranodale proteiner av type neurofascin-155 (NF155), isoformene neurofascin-186/140 (NF186/140) og contactin-1 (CNTN1) og contactin-assosiert protein 1 (Caspr1), eventuelt mot CNTN1/Caspr1-komplekset (12, 13, 14). Enkelte av disse antistoffene er også assosiert med sykdom utenfor det perifere nervesystemet. Eksempelvis er antistoffer mot NF186/140 og CNTN1/Caspr1 assosiert med glomerulonefritt, mens antistoffer mot NF155 er assosiert med demyeliniserende sykdom også i sentralnervesystemet (15). De fleste av disse antistoffene er av typen IgG4, og deres rolle i sykdomsmekanismen er relativt godt kartlagt (16). Det er også påvist antistoffer mot nodale- og paranodale proteiner av subklassene IgG2 og IgG3. Disse responderer godt på behandling med intravenøs immunglobulin G, samtidig som enkelte pasienter senere i forløpet skifter subklasse til IgG4, med påfølgende behandlingssvikt (17).
Hvis det er antistoffer av IgG4-subklassen som er årsak til nodo- og paranodale nevropatier, så responderer de som regel dårlig på behandling med intravenøs immunglobulin G, hvor aktivering av komplement og øvrige cytotoksiske prosesser spiller en rolle i patogenesen (18). Rituksimab, et monoklonalt antistoff mot CD20, eliminerer derimot B-celler og hemmer blant annet produksjon av patogent IgG4, med en klinisk behandlingsrespons på opp mot 80 % ved slike autoimmune nevropatier (19).
Hos vår pasient ble det påvist antistoffer mot Caspr1. Dette er et cellebindingsprotein uttrykt i nevroner, og som i den paranodale sonen danner et kompleks sammen med contactin-1. Komplekset binder seg til NF-155 i det omliggende myelinet, og sikrer på denne måten adekvat kontakt mellom aksonet og det omsluttende myelinet, som er en forutsetning for rask og energieffektiv nerveledning (14). Antistoffer mot hvert av disse proteinene vil kunne medføre ikke bare redusert kontakt mellom akson og myelin, men også deorganisering av nodale ionekanaler, med elektrofysiologiske tegn til både demyelinisering med blokkdannelse og aksonal skade (20).
Ved diagnostikk av autoimmune nevropatier kan påvisning av antistoffer være av betydning, men tolkning må alltid vurderes sammen med kliniske funn (21). Ved mistanke om Miller-Fishers syndrom, multifokal motornevropati eller IgM paraproteinemisk polynevropati kan henholdsvis antistoffer mot GQ1b, GM1 og MAG være av diagnostisk verdi (22, 23, 24). Dette er antistoffer mot gangliosider og glykolipider som også finnes i noden/paranoden i det perifere nervesystemet (tabell 1).
Tabell 1
Autoimmune nevropatier assosiert med ulike nodo-paranodale antistoffer (9, 13–15, 21, 25, 26).
| Antigen | Klinisk fenotype | Kliniske funn | Elektrofysiologiske funn | Andre funn | Behandling |
|---|---|---|---|---|---|
| Gangliosid/glykolipid | |||||
| GM1, GD1a | Guillain-Barrés syndrom (AMAN) | Akutt aksonal motorisk variant | Motorisk aksonal, konduksjonssvikt | Immunglobulin G | |
| GM1, GD1a | Guillain-Barrés syndrom (AMSAN) | Akutt aksonal sensorisk-motorisk variant | Sensorisk-motorisk aksonal, konduksjonssvikt | Immunglobulin G | |
| GD1b, GQ1b | Guillain-Barrés syndrom (ASAN) | Akutt sensorisk variant med ataksi | Sensorisk aksonal | Immunglobulin G | |
| GQ1b, GT1a | Miller-Fishers syndrom / Faryngo-cerviko-brakial variant (FCB) | Akutt oftalmoplegi, arefleksi og ataksi. Svakhet orofaryngealt, cervikalt og proksimalt i overekstremitetene ved FCB | Aksonal, konduksjonssvikt | Immunglobulin G | |
| GM1 | Multifokal motornevropati (MMN) | Kronisk asymmetrisk isolert motorisk nevropati hovedsakelig i overekstremitetene | Demyeliniserende med konduksjonsblokk | Immunglobulin G | |
| MAG | Distal variant (DADS) | Symmetrisk distal parese mest uttalt i underekstremitetene med sensorisk ataksi | Sensorisk dominerende distal demyelinisering | Monoklonal IgM paraproteinemi, eventuell hematologisk malignitet | Rituksimab |
| Proteiner | |||||
| NF186/140 | Kronisk inflammatorisk demyeliniserende polynevropati | Sensorisk ataksi og hos enkelte hjernenerveutfall | Demyeliniserende med konduksjonsblokk uten temporal dispersjon | Nefrotisk syndrom | Rituksimab |
| NF155 | Kronisk inflammatorisk demyeliniserende polynevropati | Unge pasienter med subakutt til kronisk innsettende distale pareser, ataksi og tremor | Demyeliniserende med konduksjonsblokk og temporal dispersjon | Multippel sklerose, nevromyelitis optica | Rituksimab |
| PanNF (kombinasjon NF155, NF186/140) | Guillain-Barrés syndrom | Raskt progredierende nevropati med påvirkning av hjernenerver, autonom funksjon og respirasjon | Demyelinisernde med konduksjonsblokk og temporal dispersjon | Nefrotisk syndrom | Rituksimab |
| CNTN1, Caspr1 | Guillain-Barrés syndrom | Subakutt distal parese med ataksi og hos mange tremor. Nevropatiske smerter er vanlig | Demyeliniserende med konduksjonsblokk og temporal dispersjon | Nefrotisk syndrom | Rituksimab |
Slike antistoffer rekvireres separat som ledd i gangliosidpanel og anti-MAG som separat undersøkelse. Antistoffer mot nodale og paranodale proteiner som NF155, NF186, CNTN1 og Caspr1 rekvireres som eget panel. Disse undersøkelsene kan utføres både ved Haukeland universitetssjukehus og ved Ullevål sykehus.
Som ledd i utredning av autoimmune nevropatier, som Guillain-Barrés syndrom og kronisk inflammatorisk demyeliniserende polynevropati, kan påvisning av ulike nodale og paranodale antistoffer være viktig for å kunne identifisere undergrupper av disse sykdommene. Ved korrekt diagnostikk og behandling er prognosen oftest god for slike autoimmune nevropatier.
Pasienten har gitt samtykke til at artikkelen blir publisert.
Artikkelen er fagfellevurdert.
- 1.
GBD 2021 Low Back Pain Collaborators. Global, regional, and national burden of low back pain, 1990-2020, its attributable risk factors, and projections to 2050: a systematic analysis of the Global Burden of Disease Study 2021. Lancet Rheumatol 2023; 5: e316–29. [PubMed][CrossRef]
- 2.
Melman A, Lord HJ, Coombs D et al. Global prevalence of hospital admissions for low back pain: a systematic review with meta-analysis. BMJ Open 2023; 13: e069517. [PubMed][CrossRef]
- 3.
Davis D, Maini K, Taqi M et al. Sciatica. Treasure Island, FL: StatPearls, 2024.
- 4.
Leonhard SE, Mandarakas MR, Gondim FAA et al. Diagnosis and management of Guillain-Barré syndrome in ten steps. Nat Rev Neurol 2019; 15: 671–83. [PubMed][CrossRef]
- 5.
Kanbayashi T, Sonoo M. Acute-Onset Chronic Inflammatory Demyelinating Polyradiculoneuropathy. Brain Nerve 2015; 67: 1388–96. [PubMed]
- 6.
van Doorn PA. Treatment of Guillain-Barré syndrome and CIDP. J Peripher Nerv Syst 2005; 10: 113–27. [PubMed][CrossRef]
- 7.
Stino AM, Naddaf E, Dyck PJ et al. Chronic inflammatory demyelinating polyradiculoneuropathy-Diagnostic pitfalls and treatment approach. Muscle Nerve 2021; 63: 157–69. [PubMed][CrossRef]
- 8.
Storstein A, Vedeler CA. Paraneoplastiske nevrologiske syndromer. Tidsskr Nor Legeforen 2009; 129: 524–8. [PubMed][CrossRef]
- 9.
Van den Bergh PYK, van Doorn PA, Hadden RDM et al. European Academy of Neurology/Peripheral Nerve Society guideline on diagnosis and treatment of chronic inflammatory demyelinating polyradiculoneuropathy: Report of a joint Task Force-Second revision. Eur J Neurol 2021; 28: 3556–83. [PubMed][CrossRef]
- 10.
Bunschoten C, Jacobs BC, Van den Bergh PYK et al. Progress in diagnosis and treatment of chronic inflammatory demyelinating polyradiculoneuropathy. Lancet Neurol 2019; 18: 784–94. [PubMed][CrossRef]
- 11.
van Doorn PA, Hadden RDM, Van den Bergh PYK. Elucidating autoimmune nodopathies and the CIDP spectrum. Brain 2021; 144: 1043–5. [PubMed][CrossRef]
- 12.
Shelly S, Klein CJ, Dyck PJB et al. Neurofascin-155 Immunoglobulin Subtypes: Clinicopathologic Associations and Neurologic Outcomes. Neurology 2021; 97: e2392–403. [PubMed][CrossRef]
- 13.
Burnor E, Yang L, Zhou H et al. Neurofascin antibodies in autoimmune, genetic, and idiopathic neuropathies. Neurology 2018; 90: e31–8. [PubMed][CrossRef]
- 14.
Pascual-Goñi E, Fehmi J, Lleixà C et al. Antibodies to the Caspr1/contactin-1 complex in chronic inflammatory demyelinating polyradiculoneuropathy. Brain 2021; 144: 1183–96. [PubMed][CrossRef]
- 16.
Maslinska M, Dmowska-Chalaba J, Jakubaszek M. The Role of IgG4 in Autoimmunity and Rheumatic Diseases. Front Immunol 2022; 12: 787422. [PubMed][CrossRef]
- 17.
Appeltshauser L, Brunder AM, Heinius A et al. Antiparanodal antibodies and IgG subclasses in acute autoimmune neuropathy. Neurol Neuroimmunol Neuroinflamm 2020; 7: e817. [PubMed][CrossRef]
- 18.
Dalakas MC. IgG4-Mediated Neurologic Autoimmunities: Understanding the Pathogenicity of IgG4, Ineffectiveness of IVIg, and Long-Lasting Benefits of Anti-B Cell Therapies. Neurol Neuroimmunol Neuroinflamm 2021; 9: e1116. [PubMed][CrossRef]
- 19.
Martín-Aguilar L, Lleixà C, Pascual-Goñi E et al. Clinical and Laboratory Features in Anti-NF155 Autoimmune Nodopathy. Neurol Neuroimmunol Neuroinflamm 2021; 9: e1098. [PubMed][CrossRef]
- 20.
Uncini A. Autoimmune nodo-paranodopathies 10 years later: Clinical features, pathophysiology and treatment. J Peripher Nerv Syst 2023; 28 (Suppl 3): S23–35. [PubMed][CrossRef]
- 21.
Shastri A, Al Aiyan A, Kishore U et al. Immune-Mediated Neuropathies: Pathophysiology and Management. Int J Mol Sci 2023; 24: 7288. [PubMed][CrossRef]
- 22.
Spatola M, Du Pasquier R, Schluep M et al. Serum and CSF GQ1b antibodies in isolated ophthalmologic syndromes. Neurology 2016; 86: 1780–4. [PubMed][CrossRef]
- 23.
Lawson VH, Arnold WD. Multifocal motor neuropathy: a review of pathogenesis, diagnosis, and treatment. Neuropsychiatr Dis Treat 2014; 10: 567–76. [PubMed]
- 24.
Traub R, Qarni T, Cohen AD et al. Paraproteinemic neuropathies. Muscle Nerve 2024; 70: 173–9. [PubMed][CrossRef]
- 25.
van Doorn PA, Van den Bergh PYK, Hadden RDM et al. European Academy of Neurology/Peripheral Nerve Society Guideline on diagnosis and treatment of Guillain-Barré syndrome. Eur J Neurol 2023; 30: 3646–74. [PubMed][CrossRef]
- 26.
Menon D, Katzberg HD, Bril V. Treatment Approaches for Atypical CIDP. Front Neurol 2021; 12: 653734. [PubMed][CrossRef]