En kvinne i 50-årene med postoperativ infeksjon, generalisert utslett og organsvikt
En kvinne i 50-årene utviklet symptomer på infeksjon og multiorgansvikt få dager etter operasjon for brystkreft. Et utslett i huden ga oss hint om en sjelden tilstand.
En kvinne i 50-årene ble akuttinnlagt i kirurgisk mottak på sitt lokalsykehus grunnet feber, redusert allmenntilstand og tungpust femte postoperative døgn etter dagkirurgisk operasjon for cancer mamma dexter med brystbevarende kirurgi og vaktpostlymfeknutediagnostikk.
Kvinnen hadde kjent diabetes mellitus type 1, hypertensjon, migrene, kols og fibromyalgi. Hun røkte under 10 sigaretter daglig. Av faste medisiner brukte hun insulinpumpe, enalapril 20 mg per os og acetylsalicylsyre 75 mg per os.
Ved innkomst var kvinnen våken og klar, hun hadde kroppstemperatur på 38,6 °C, respirasjonsfrekvens på 20/min, saturasjon på 97 %, puls på 95/min og blodtrykk på 133/56 mmHg, samt lett rødme og væsking fra operasjonssåret på brystet.
Blodprøvene viste CRP 332 mg/L (referanseområde < 5), leukocytter 10,1 ∙ 109/L (3,5–8,8), hvorav nøytrofile granulocytter 9,6 ∙ 109/L (1,5–7,3), kreatinin 101 μmol/L (45–90) og eGFR 53 ml/min/1,7m2 (≥ 60). Arteriell blodgass viste pH 7,41 (7,35–7,45), pCO2 4,2 kPa (4,64–6,40), pO2 8,6 kPa (11,1–14,4) og laktat 1,1 mmol/L (0,7–1,6).
Postoperativ sårinfeksjon er den vanligste komplikasjonen etter brystkirurgi. Det kan medføre dårligere kosmetisk resultat, forsinke oppstart av adjuvant behandling og er belastende for pasienten. Ifølge Nasjonalt kvalitetsregister for brystkreft var andelen sårinfeksjoner som krevde antibiotikabehandling 4,9 % i 2022 (1).
Kvinnen oppfylte ingen av qSOFA-kriteriene (quick Sequential Organ Failure Assessment Score), men hun oppfylte tre av fire kriterier for systemisk inflammatorisk responssyndrom (SIRS), og hun hadde tegn på organdysfunksjon med dyspné og redusert nyrefunksjon. Man mistenkte derfor begynnende sepsis. Det ble tatt blodkulturer, urinprøve og nasofarynks-PCR, og det ble startet sepsisbehandling med intravenøs kloksacillin 2 g × 4 og gentamicin 420 mg × 1.
Ifølge Helsedirektoratets veileder for antibiotikabehandling i sykehus anbefales kloksacillin 2 g × 6 intravenøst og gentamicin 6 mg/kg × 1 intravenøst ved sepsis med mistenkt utgangspunkt i hud eller bløtvev. Vår pasient fikk startet behandling i tråd med dette.
Ettersom det ikke var bryst- og endokrinkirurg på sykehuset, ble pasienten samme dag flyttet til universitetssykehuset hvor hun var operert. Her fant man at hun hadde utviklet et kløende, diffust, symmetrisk utbredt erytem på toraks og ekstremiteter. Etter mistanke om allergisk legemiddelreaksjon på antibiotika skiftet man derfor over til klindamycin 600 mg × 4 intravenøst i monoterapi og startet antihistaminer, desloratadin 5 mg × 2 peroralt.
Penicillinallergi rapporteres ofte, men har en reell forekomst < 1 % (2). Type 1-reaksjon oppstår i løpet av minutter og gir alvorlig anafylaktisk reaksjon. Type 4-reaksjon er en forsinket hypersensitivitetsreaksjon, mediert via T-celler i huden, og gir vanligvis et kløende makulopapuløst eksantem innenfor 1–2 uker som kan behandles med antihistaminer eller steroider (2).
Dagen etter overflyttingen ble pasienten dårligere. NEWS (National Early Warning Score), et skåringssystem for å bedømme vitale funksjoner, økte fra 2 til 9. Hun var våken og noe uklar. Til tross for infusjon av totalt 1 L Ringer-Acetat og 2 L NaCl 9 mg/ml, samt væskestøt med 250 ml NaCl, hadde hun blodtrykk på 88/54 mmHg. Puls var på 99/min, respirasjonsfrekvens på 26/min, saturasjon på 95 % i romluft og kroppstemperatur på 38,4 °C. Hun var anurisk og blodprøvene viste akutt nyresvikt med kreatinin 258 μmol/L (45 - 90), eGFR 17 ml/min/1,7m2 (≥ 60) og karbamid 15 mmol/L (2,6–6,4). Elektrolyttprøver viste moderat hyponatremi 128 mmol/L (137–145) og normal kalium 4,2 mmol/L (3,6–5,0). Arteriell blodgass viste kompensert metabolsk acidose med pCO2 3,9 kPa (4,64–6,40), laktat 4 mmol/L (0,7–1,6) og base excess - 4 (-3–3). Forhøyet CRP-verdi og leukocyttall var uendret. Hun anga ingen muskelsmerter og kreatinkinase var normal.
Funnene ga mistanke om septisk sjokk da hun hadde tegn til sirkulasjonssvikt med lavt blodtrykk og høy laktat tross initial væskeresuscitering.
Kvinnen ble flyttet til intensivavdeling for vasopressorbehandling. Her var hun respiratorisk stabil og selvpustende uten behov for oksygen. Hun holdt middelarterietrykk > 65 mmHg med høyeste dose noradrenalin på 0,08 μg/kg/min intravenøst. Hun fikk infusjon med Ringer-Acetat og hadde en sparsom, men økende timediurese på 30 ml/t. Det var ikke behov for glukokortikoider da hun responderte raskt og stabiliserte seg på vasopressor og væske. På mistanke om en alvorlig streptokokk- eller stafylokokkinfeksjon ble antibiotikabehandlingen utvidet med infusjon av cefotaksim 2 g × 3 (i tillegg til allerede oppstartet klindamycin).
Pasientens nyresvikt ble tolket som prerenal på bakgrunn av hypovolemi og sepsis. Aminoglykosider som gentamicin, som pasienten fikk en enkeltdose av ved innleggelsen, er nefrotoksisk og kan ha bidratt til forverring av hennes nyrefunksjon.
Kvinnen hadde også diaré med 3–4 løse tømninger per døgn. Man testet for covid-19 og influensa, samt Clostridium difficile, som alle var negative. Leververdiene var lett påvirket med ALAT 70 U/L (10–45), ASAT 60 U/L (15–35), GT 195 U/L (10–75) og ALP 330 U/L (35–105). Bilirubin total var normal 17 μmol/L (< 26). Hun hadde ingen petekkier eller ekkymoser i huden, og koagulasjonsprøver viste INR 1,2 (0,8–1,2), samt trombocytter innenfor normalt referanseintervall. Hun hadde forhøyet D-dimer 4,7 mg/L (< 0,5), APTT 62 sekunder (22–30) og fibrinogen 6,4 g/L (1,7–4,2).
Pasienten ble vurdert med tanke på disseminert intravaskulær koagulasjon (DIC). Forhøyet D-dimer og APTT styrket mistanken, mens forhøyet fibrinogen, normal INR og trombocytter, samt ingen kliniske tegn på blødning, svekket mistanken. Pasienten skåret derfor lavt (2 poeng) på The International Society on Thrombosis and Haemostasis (ISTH) sin DIC-skår, og DIC ble således vurdert mindre sannsynlig.
Kvinnen ble økende tung i pusten etter flytting til intensivavdeling. Røntgen toraks viste stuvning og små mengder bilateral pleuravæske. I tillegg utviklet hun pittingødem i alle fire ekstremiteter, og blodprøvene viste en proBNP på 13 505 ng/L (≤ 287). Blodkulturer tatt første, andre og fjerde innleggelsesdøgn, forelå etter fem dager og var negative. EKG viste smalkomplekset sinustakykardi med normal akse, uten tegn til iskemi eller grenblokk. Ekkokardiografi viste god biventrikulær funksjon med ejeksjonsfraksjon på 58 %. Det ble ikke påvist vegetasjoner på klaffene eller andre holdepunkter for endokarditt. Venstre atrium var forstørret, 51 ml/m2, høyre atrium var ikke forstørret, 30 ml/m2, og hun hadde en liten trikuspidalinsuffisiens. Trikuspidal gradient ble målt til 2,7 m/s (< 2,8). Det ble konkludert med diastolisk dysfunksjon grad 2. Hun fikk vanndrivende behandling med furosemid 20 mg × 2 per os, som hadde god klinisk effekt.
Vår pasient utviklet i løpet av første innleggelsesdøgn multiorgansvikt med anurisk nyresvikt, leverpåvirkning, diastolisk hjertesvikt og lungestuvning, samt gastrointestinale symptomer. Sykehistorien og pasientens symptomer kunne gi mistanke om bakteriemi med gule stafylokokker og endokarditt. Transtorakal ekkokardiografi viste imidlertid ingen tegn til endokarditt, og pasienten hadde ingen bilyd på hjertet, ingen tegn til tromboembolier og ingen predisponerende faktorer. Blodkulturer viste heller ingen oppvekst av bakterier. Endokarditt ble således raskt vurdert som mindre sannsynlig, og man valgte å ikke gå videre med en transøsofageal ekkokardiografi.
Dagen etter overflytting så vi også at utslettet hadde spredd seg til hele kroppen, og at huden i håndflatene og på fotsålene begynte å skalle av (figur 1). Sykehistorien og det kliniske bildet fikk oss til å tenke på toksisk sjokk-syndrom. Til tross for kun sparsom rødme omkring operasjonssåret på brystet, valgte brystkirurg å åpne og revidere såret i lokalanestesi på intensivavdelingen. Det var ikke synlig puss eller væskeansamling i såret, og vevet så friskt ut. Man sikret prøver fra såret til dyrkning og lukket huden kun delvis, slik at eventuell væske kunne sive ut.

Etter to dager på intensivavdelingen var pasienten respiratorisk og sirkulatorisk stabil, og hun ble flyttet til sengepost. På grunn av vedvarende kroppstemperatur over 38 °C, organsviktsymptomer i form av dyspné, nyresvikt og hjertesvikt, samt vedvarende forhøyet CRP (200 mg/L) og leukocytter (21 ∙ 109/L) i over fire dager, valgte man å re-operere henne på operasjonsstue i generell anestesi. Det ble utført kvadrantektomi av hele nedre mediale kvadrant høyre mamma, tilsvarende det affiserte området, og det ble på nytt tatt prøver til dyrkning.
Allmenntilstanden ble etter dette betydelig bedre, utslettet bleknet og huden skallet av i håndflater og på føttene. Nyrefunksjonen var normal etter ti dager. Infeksjonstallene falt gradvis: på niende dag var CRP 69 mg/L og leukocytter 17,5 ∙ 109/L. Dyrkninger fra operasjonssåret forelå på femte dag og viste renkultur av gule stafylokokker. Antibiotika ble skiftet til per oral dikloksacillin 1 g × 4, i henhold til resistensbestemmelse. Pasienten ble utskrevet etter 15 dager med dicloksacillin (total antibiotikabehandling i 22 dager) og furosemid i nedtrappende doser.
Ved poliklinisk kontroll tre uker senere var proBNP på 740 ng/L (≤ 287), og infeksjonsparametere, nyrefunksjon og leververdier var normale. Såret på brystet så fredelig ut, og det ble lukket sekundært i lokalanestesi på poliklinikken.
Det var det skarlatiniforme utslettet i håndflatene som vekket oppsikt og fikk oss til å tenke på toksisk sjokk-syndrom. Det er en svært sjelden, men livstruende tilstand som skyldes superantigenproduserende bakterier, typisk Staphylococcus aureus eller Streptococcus pyogenes (3).
Diskusjon
Insidens er omkring 0,5 og 0,4 per 100 000 per år for henholdsvis stafylokokk- og streptokokktoksisk sjokk-syndrom (4). Etiologi med stafylokokker fikk stor oppmerksomhet rundt 1980-tallet da sykdommen var hyppig assosiert med bruk av hyperabsorberende tamponger. I dag er tilstanden oftest ikke menstruasjonsassosiert, men den kan ses postoperativt, post partum, ved intrauterin spiral, brannsår eller hud- og bløtdelsinfeksjoner. Mortalitet ved menstruasjonsassosierte tilfeller er < 5 %, mens den ved ikke-menstruasjonsassosierte tilfeller er helt oppe i 22 % (4, 5).
Tilstanden forårsakes av eksotoksiner som virker som bakterielle superantigener. Det er identifisert 24 stafylokokk- og 12 streptokokk-superantigener. Blant de mest alminnelige er toksisk sjokk-syndrom-toksin-1 (TSST-1), som opptil 50 % av Staphylococcus aureus kan danne (6). Over 90 % har utviklet antistoffer mot TSST-1 i voksen alder (3).
Ved normal immunrespons tas antigener opp av antigenpresenterende celler og presenteres i vevsforlikelighetsgenkompleks (major histocompatibility complex II, MHC klasse II) for antigenspesifikke T-celler. Kun 0,01–0,001 % av T-cellene er spesifikke for det aktuelle antigenet og vil bli aktivert. Superantigener er derimot i stand til å binde seg direkte til MHC II-molekyler og deretter til en del av T-cellereseptoren som finnes på alle T-celler. Dermed kan eksotoksinene aktivere opp til 30 % av T-cellene (figur 2) (7).
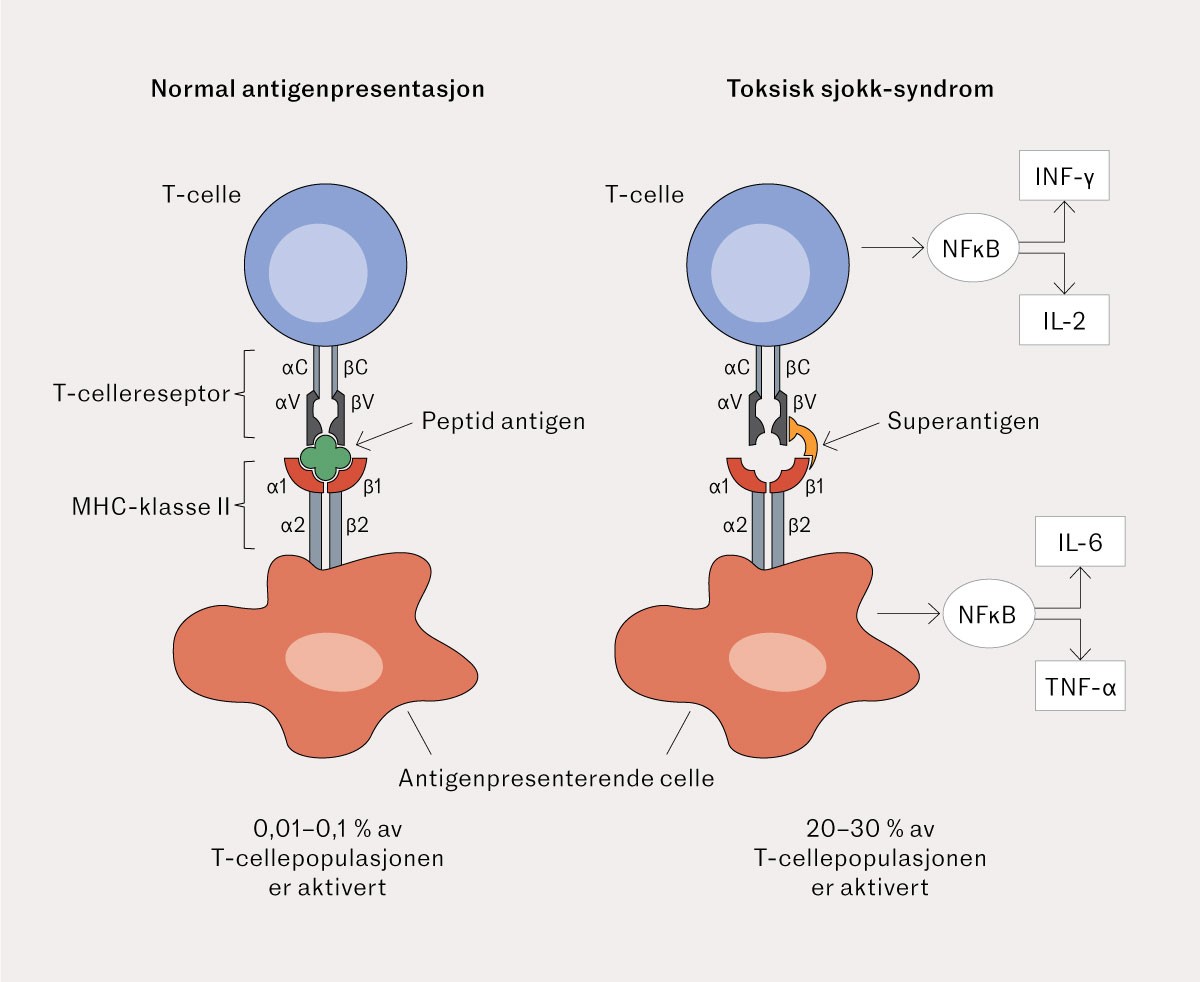
Aktiveringen fører til massiv ekspresjon av proinflammatoriske cytokiner som lymfotoksin-alfa, interleukin-1, -2, og -6, interferon-gamma og tumornekrosefaktor. Interleukin-1 kan gi muskelproteolyse. TSST-1-superantigenet har direkte effekt på blodkar og medfører kapillærlekkasje og hypotensjon. Klassiske infeksjonstegn kan være fokalt beskjedne, da superantigener via overproduksjon av tumornekrosefaktor hemmer makrofaginfiltrasjon i det infiserte området (4, 8, 9) – slik vår pasient kun hadde sparsomme funn i og ved operasjonssåret.
Symptomer på toksisk sjokk-syndrom utvikler seg raskt (innen 48 timer). Den direkte effekten av toksiner og cytokiner, samt hypotensjonen, resulterer i multiorgansvikt som typisk innsetter 8–12 timer etter symptomdebut (10). Rask diagnostikk og behandling er derfor avgjørende for å redusere mortalitet og morbiditet. Diagnosen stilles klinisk, og det finnes ingen paraklinisk test for å skille toksisk sjokk-syndrom fra andre stafylokokk- eller streptokokkinfeksjoner. Det finnes diagnostiske kriterier, utviklet av Centers for Disease Control and Prevention, å støtte seg til, men disse kan ikke brukes til å utelukke toksisk sjokk-syndrom i individuelle tilfeller der man har mistanke om tilstanden (11).
Klassisk utvikles et diffust erytem som utgår fra toraks og sprer seg til ekstremiteter, spesielt på håndflater og fotsåler med påfølgende karakteristisk avskalning av huden her (figur 1). Andre typiske symptomer og tegn omfatter høy feber, lavt blodtrykk, muskelsmerter (rabdomyolyse), nyresvikt, leversvikt, kardiomyopati, lungeødem og pleuraeffusjon, oppkast og diaré, hodepine, konjunktival, orofaryngeal og vaginal hyperemi, anemi, trombocytopeni og disseminert intravaskulær koagulasjon (10). Viktige differensialdiagnoser er septisk sjokk forårsaket av andre patogener, legemiddelreaksjon, meningokokker og inflammatorisk multisystemsyndrom ved covid-19.
Behandlingen består av støttebehandling for å reversere sjokktilstanden, samt kirurgi og antibiotika. Sår kan se fredelige ut på grunn av svekket inflammatorisk respons, men kirurgisk debridement er likevel nødvendig (12). Videre er det viktig å fjerne eventuelle fremmedlegemer ved mistenkt fokus, som tampong, spiral, skitne bandasjer og piercing (9, 10, 13). Empirisk antibiotikabehandling er ifølge antibiotikaveilederen benzylpenicillin 2,4 g × 6 intravenøst ved streptokokker og kloksacillin 2 g × 6 intravenøst ved stafylokokker (14). Ved penicilliner virker baktericid ved å hemme dannelsen av bakterienes cellevegg. I tillegg er det viktig å legge til klindamycin 900 mg × 3 intravenøst som hemmer bakterienes proteinsyntese og dermed dannelsen av toksiner (6). Denne kombinasjonen av betalaktamantibiotika og klindamycin har vist seg å være mest effektiv og bør være førstevalget (6). Intravenøs immunglobulin kan gis som tilleggsbehandling, da det har en antiinflammatorisk og immunmodulerende effekt, blant annet ved å inaktivere sirkulerende superantigener (4, 13). Flere observasjonsstudier peker på lavere mortalitet ved bruk av intravenøs immunglobulin, men evidensen er usikker i mangel av randomiserte kontrollerte studier (4).
Over 90 % utvikler antistoffer mot TSST-1 innen 25 års alder. Toksisk sjokk-syndrom med TSST-1 rammer kun de 10 % som ikke har antistoffer (15). Halvparten av disse pasientene serokonverterer ikke, og de har nedsatt evne til å danne antistoffer etter sykdomsperioden og er således i økt risiko for en ny episode (15).
Toksisk sjokk-syndrom antas å være underdiagnostisert da en del pasienter først i retrospekt oppfyller kriteriene (8). I dag er tilstanden oftest ikke menstruasjonsassosiert, og man bør ha toksisk sjokk-syndrom i mente hos nyopererte pasienter som raskt utvikler høy feber, utslett og multiorgansvikt.
Pasienten har gitt samtykke til at artikkelen blir publisert.
Artikkelen er fagfellevurdert.
- 1.
Nasjonalt kvalitetsregister for brystkreft. Årsrapport 2022 med resultater og forbedringstiltak fra Nasjonalt kvalitetsregister for brystkreft. https://www.kvalitetsregistre.no/sites/default/files/2023-06/%C3%85rsrapport%202022%20Nasjonalt%20kvalitetsregister%20for%20brystkreft.pdf Lest 22.2.2024.
- 2.
Berild D. Penicillinallergi. https://antibiotikaiallmennpraksis.no/index.php?action=topic&item=pJHa548e Lest 22.2.2024.
- 3.
Gottlieb M, Long B, Koyfman A. The evaluation and management of toxic shock syndrome in the emergency department: a review of the literature. J Emerg Med 2018; 54: 807–14. [PubMed][CrossRef]
- 4.
Burnham JP, Kollef MH. Understanding toxic shock syndrome. Intensive Care Med 2015; 41: 1707–10. [PubMed][CrossRef]
- 5.
Descloux E, Perpoint T, Ferry T et al. One in five mortality in non-menstrual toxic shock syndrome versus no mortality in menstrual cases in a balanced French series of 55 cases. Eur J Clin Microbiol Infect Dis 2008; 27: 37–43. [PubMed][CrossRef]
- 6.
Annane D, Clair B, Salomon J. Managing toxic shock syndrome with antibiotics. Expert Opin Pharmacother 2004; 5: 1701–10. [PubMed][CrossRef]
- 7.
Celie KB, Colen DL, Kovach SJ. Toxic Shock Syndrome after Surgery: Case Presentation and Systematic Review of the Literature. Plast Reconstr Surg Glob Open 2020; 8: e2499. [PubMed][CrossRef]
- 8.
Hansen NS, Leth S, Nielsen LT. Toxic shock syndrome. Ugeskr Laeger 2020; 182: V11190673. [PubMed]
- 9.
Lappin E, Ferguson AJ. Gram-positive toxic shock syndromes. Lancet Infect Dis 2009; 9: 281–90. [PubMed][CrossRef]
- 10.
Murray RJ. Recognition and management of Staphylococcus aureus toxin-mediated disease. Intern Med J 2005; 35 (Suppl 2): S106–19. [PubMed][CrossRef]
- 11.
Centers for Disease Control and Prevention. Case definitions for infectious conditions under public health surveillance. MMWR Recomm Rep 1997; 46 (RR-10): 1–55. [PubMed]
- 12.
Spaulding AR, Salgado-Pabón W, Kohler PL et al. Staphylococcal and streptococcal superantigen exotoxins. Clin Microbiol Rev 2013; 26: 422–47. [PubMed][CrossRef]
- 13.
Wilkins AL, Steer AC, Smeesters PR et al. Toxic shock syndrome - the seven Rs of management and treatment. J Infect 2017; 74 (Suppl 1): S147–52. [PubMed][CrossRef]
- 14.
Helsedirektoratet. Antibiotika i sykehus. https://www.helsedirektoratet.no/retningslinjer/antibiotika-i-sykehus/hud-og-blotdelsinfeksjoner. Lest 1.2.2024.
- 15.
Parsonnet J, Hansmann MA, Delaney ML et al. Prevalence of toxic shock syndrome toxin 1-producing Staphylococcus aureus and the presence of antibodies to this superantigen in menstruating women. J Clin Microbiol 2005; 43: 4628–34. [PubMed][CrossRef]