Anemi hos barn og ungdommer er ikke uvanlig og kan ha mange ulike årsaker. Vanligvis er det enkelt å finne den sannsynlige årsaken, men i noen tilfeller viser diagnosen seg å være sjelden og vanskelig å stille.
En tidligere frisk gutt i barnehagealder ble innlagt på sitt lokalsykehus grunnet tiltagende slapphet og lav hemoglobin målt på lokalt legekontor. Han hadde blitt behandlet for en pyelonefritt i første leveår, og i den forbindelse ble det gjort miksjonsurethrocystografi og ultralydundersøkelse av urinveier som begge var normale. Ut over dette hadde han hatt hyppige øvre luftveisinfeksjoner, men ellers vært frisk. Ved innkomst på lokalsykehuset hadde gutten symptomer på luftveisinfeksjon, god almenntilstand, lett takypné (respirasjonsfrekvens på 20/minutt) og en kroppstemperatur på 38,5 grader. Blodprøver viste alvorlig anemi med nivå av hemoglobin (Hb) på 3,2 g/dL (referanseområde: 10,5–13,5 g/dL), trombocytt-tall på 596 ∙ 109/L (145–348 ∙ 109/L) og normale røde celleindekser (gjennomsnittlig erytrocyttvolum (mean corpuscular volume: MCV) på 85 fL (70–86 fL), gjennomsnittlig hemoglobinnivå i erytrocytter (mean cell hemoglobin: MCH) på 28 pg/celle (23–31 pg/celle)). Nivå av hvite blodceller var normalt (14,2 ∙ 109/L, (4,0–17,2 ∙ 109/L)), mens C-reaktivt protein (CRP) var lett forhøyet (40 mg/L (< 5 mg/L)). Nivåer av ferritin var 200 ∙ 10-6 g/L (15–200 ∙ 10-6 g/L), kobolamin 312 pmol/L (145–540 pmol/L), folat 22,9 nmol/L (> 7 nmol/L), og retikulocytt-tallet < 0,005 ∙ 1012/L (0,03–0.10 ∙ 1012/L). Hemolyseparametre var negative (normale nivåer av haptoglobin, bilirubin og laktatdehydrogenase).
Definisjonen av anemi hos barn er Hb-nivå på eller under 2,5-persentilen for alder og kjønn, basert på normale verdier fra friske individer. Globalt er jernmangel den vanligste årsaken til anemi hos barn (1). Jernmangelanemi kjennetegnes biokjemisk av isolert lavt Hb-nivå uten påvirkning av andre cellerekker, små og bleke erytrocytter (lav MCV og/eller MCH), kombinert med lav ferritin (som kan være falsk forhøyet ved samtidig inflammasjon/infeksjon), forhøyet løselig transferrinreseptornivå (upåvirket av akutt fase) samt fravær av hemolyse. Klinisk er barna hemodynamisk stabile og ofte relativt upåvirket av sin anemi siden anemien utvikles over tid. Jernmangelanemi hos små barn er som oftest forårsaket av for lite jern i kosten og kan effektivt behandles med jerntilskudd. Anbefalinger per 2022 er toverdig jerntilskudd i doseringen 3 mg/kg (maks 65 mg) en gang daglig per os, og kostholdsråd (2). Ved normokrom, ikke-hemolytisk alvorlig anemi hos ellers friske førskolebarn over ett års alder er transitorisk erytroblastopeni høyt oppe på diagnoselisten. Dette kjennetegnes av en stans i produksjonen av røde blodlegemer, hvor man ser alvorlig reduksjon i erytroide forstadier i en ellers normocellulær benmarg. Transitorisk erytroblastopeni er imidlertid en eksklusjonsdiagnose, og benmargsprøve er sjelden indisert. Forekomsten er ukjent, men sannsynligvis betydelig underdiagnostisert (3). Tilstanden kjennetegnes av et ofte svært lavt Hb-nivå for alderen, men som oftest god almenntilstand, lave retikulocytter (som stiger senere i forløpet når erytropoesen i benmargen gjenopptas) og fravær av andre årsaker til anemi (figur 1) (3, 4). Anemien er vanligvis normocytær, men MCV kan være lett forhøyet under tilfriskningsfasen på grunn av retikulocytose. Transitorisk erytroblastopeni er en selvbegrensende tilstand, og blodverdiene normaliseres i løpet av uker til måneder. I noen tilfeller er det behov for blodtransfusjon i den aplastiske fasen. Det er vanligvis ingen sikker utløsende årsak.
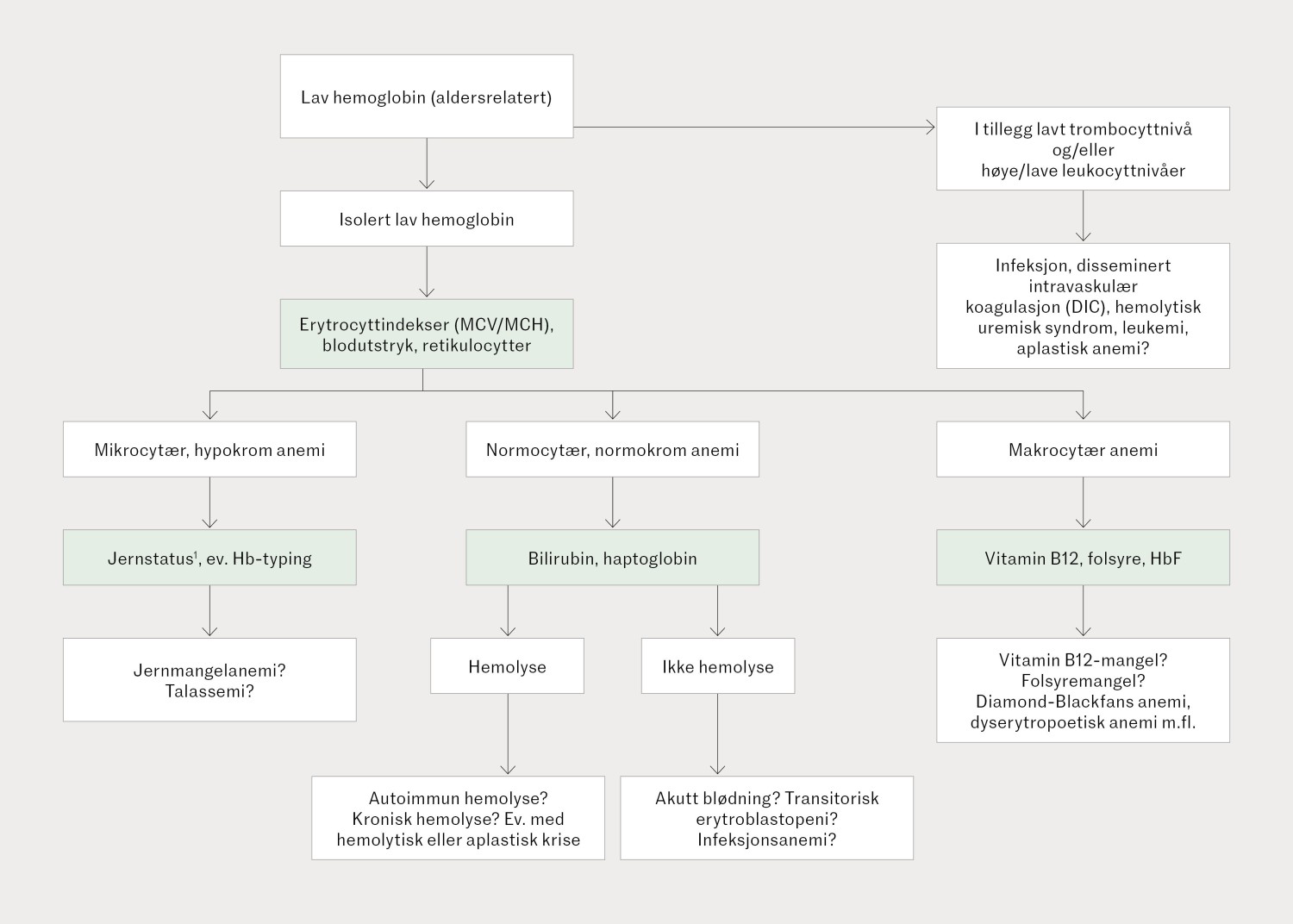
Arbeidsdiagnosen for pasienten ble transitorisk erytroblastopeni, og barnet fikk en blodtransfusjon, hvorpå Hb-nivået steg til 7,5 g/dL. Gutten var i god form og ble utskrevet dagen etter. Kontroll på sykehuset ni dager senere viste et Hb-nivå på 8,0 g/dL, lett forhøyet MCV (89 fL), lett forhøyet retikulocyttnivå (0,108 ∙ 1012/L), fortsatt lett trombocytose (508 ∙ 109/L) og normalt nivå av hvite blodceller (6,2 ∙ 109/L)ved maskinell differensialtelling. Han ble fulgt i ytterligere ett år på lokalsykehuset med regelmessige blodprøver, der Hb-nivået steg og stabiliserte seg i nedre normalområde (10–11 g/dL) og MCV lå i det øvre normalområdet: 86–90 fL. Ved avslutning av kontroller ett år etter innleggelsen var Hb-nivået på 10,5 g/dL, MCV 86 fL, retikulocytt-tallet 0,053 ∙ 1012/L, trombocytt-nivået 402 ∙ 109/L, og normal fordeling av hvite blodceller ved maskinell differensialtelling. På grunn av en vedvarende bilyd – til tross for tilnærmet normalisert Hb – ble barnet undersøkt poliklinisk med ekkokardiografi, som viste normal hjertefunksjon.
I barneskolealder ble det tatt nye blodprøver hos fastlege som viste lett anemi med normal MCV, lavt nivå av retikulocytter samt lett leuko- og nøytropeni. Virusserologi ga ikke holdepunkter for aktuell virusinfeksjon som årsak til benmargssuppresjon. Gutten rapporterte nå å være kronisk slapp og trøtt, og hadde et stort behov for mye søvn og hvile. Det ble derfor konferert med spesialist i pediatri. Vekstkurvene viste fin tilvekst, og kontrollprøver etter en måned viste fortsatt litt lavt Hb-nivå (10,1 g/dL), normaliserte nivåer av hvite blodceller og retikulocytter, og MCV lå i øvre normalområde. Kontrollene ble avsluttet, og ingen videre utredning ble igangsatt. Fem år senere henviste fastlegen tenåringen på ny til lokal barneavdeling grunnet urinveisproblematikk, kronisk trøtthet og anemi. Blodprøvene viste, som før, en lett anemi med Hb-nivå på 10,3 g/dL (11,5–15,5), leukopeni med leukocyttnivå på 3,9 ∙ 109/L, lettgradig nøytropeni (1,2 ∙ 109/L), normale nivåer av ferritin og kobalamin, lavt folatnivå på 5,7 nmol/L (6–36), MCV i øvre normalområde (97 fL) og normalt retikulocyttnivå (0,041 ∙ 1012/L). Gutten ble nå henvist til vurdering ved barneavdeling på nærmeste regionsykehus.
Makrocytose hos barn kan ha mange utløsende årsaker, bl.a. mangel på vitamin B12 og/eller folat (hvor homocystein og metylmalonsyrenivåer også bør måles), sigdcelleanemi, hypotyroidisme, anemi ved benmargssviktsyndromer (for eksempel Fanconis anemi og Diamond-Blackfans anemi) eller medikamentindusert anemi (f.eks. ved bruk av epilepsimedikamenter og metotreksat) (4, 5). Folatmangel kan være forårsaket av manglende inntak (som ved svært restriktive dietter og spiseforstyrrelser), økt forbruk (graviditet, kroniske hemolytiske anemier, alvorlig eksem), malabsorpsjon (cøliaki), medikamenter (som over) og svært sjeldne medfødte genetiske tilstander som hindrer folatopptak (6).
Gutten var nå i tenårene og klaget over kronisk trøtthet, intermitterende hodepine og redusert fysisk kapasitet. Til tross for dette spilte han fotball på fritiden, og klarte seg godt på skolen. Blodprøver på regionsykehuset viste fortsatt en lett makrocytær anemi: Hb 10,2 g/dL, MCV 95 fL (77–89), retikulocytter 0,029 ∙ 1012 (0,042–0,065 ∙ 1012), lav folat (4,9 nmol/L (> 10)) og D-vitaminmangel (25-OH-Vitamin D 59 nmol/L (75–250 nmol/L). Videre fant man normalt antall hvite blodceller ved differensialtelling, normalt blodutstryk og negative cøliakiprøver. Det ble startet folattilskudd (5 mg daglig per os), peroralt D-vitamintilskudd og avtalt ny kontroll ved regionsykehuset.
Fire uker senere var Hb-nivået steget til 11,8 g/dL, folatnivåene var normale (> 45 nmol/L), retikulocytter i nedre normalområde og MCV vedvarende i øvre normalområde. På dette tidspunktet ble det bestemt å gjøre en benmargsundersøkelse grunnet langvarig anemi. Benmargsbiopsi viste en normocellulær benmarg uten neoplasi, dysplasi eller modningsforstyrrelser og med god produksjon i alle tre cellerekker. Ultralyd av abdomen viste en lett forstørret milt med lengde på ca. 14 cm (øvre referanse for alderen er ca. 12 cm), ellers normale funn. På grunn av vedvarende makrocytær lettgradig anemi og på ny lavt folatnivå, ble det 18 måneder senere avtalt ny benmargskontroll og gastroskopi. Hb-nivået var da falt til 8,9 g/dL, MCV var 95, retikulocytter lave (0,036), folat 7,1 nmol/L, leukocytt-tallet 3,8 ∙ 109/L, og nøytrofile granulocytter 1,1∙ 109/L. Gutten klagde – som før – over vedvarende slapphet og stort søvnbehov. Man fant normale forhold ved gastroskopi, og ingen tegn til malabsorpsjon. Benmargsprøver var også denne gangen vurdert som normale, uten tegn til modningsforstyrrelse eller hypocellularitet og med god trilineær produksjon. Ultralyd abdomen viste vedvarende lettgradig miltforstørrelse. Ved videre oppfølging ble det rekvirert genpanel for cytopenier og genetiske årsaker til anemi og beinmargssvikt ved nærmeste universitetssykehus. På grunn av fallende Hb-nivå til 8,6 g/dL ble det besluttet å gi en blodtransfusjon på én enhet i påvente av ytterligere prøvesvar. Gutten rapporterte ingen klinisk bedring etter blodtransfusjon. I forkant av transfusjonen ble det rekvirert Hb-typing, som viste et forhøyet nivå av føtal Hb (HbF) på 3,8 % (0,0–1,0 %). Svar på cytopenipanelet viste heterozygoti for en sikker patogen variant i RPL11-genet (RPL11 (NM_000975.5) c.396 + 1G > A), forenlig med Diamond-Blackfans anemi type 7. Pasienten var nå kommet sent i tenårene, og han ble kort tid etter diagnosen overført til voksenavdeling for videre oppfølging, etter et behandlingsforsøk med L-leucin uten klinisk bedring.
Diskusjon
Diamond-Blackfans anemi er en medfødt benmargssvikt kjennetegnet av isolert anemi med retikulocytopeni, der benmargsbiopsi viser en normocellulær benmarg med redusert eller fraværende erytroide forstadier (Tabell 1). Diamond-Blackfans anemi affiserer 4–7 per million levende fødte. Det er ingen kjønnsforskjeller, og ca. 90 % blir diagnostisert i løpet av første leveår (7, 8). Biokjemisk finner man en lav hemoglobin for alder, reduserte retikulocytter og makrocytose (MCV > 97,5 persentil for alder). Ved tilleggsanalyser finner man ofte forhøyet føtal Hb (som indikator på en stresset erytropoese) og forhøyet erytrocytt adenosin deaminase (eADA) (7–9), som sammen kan brukes for å differensiere mellom transitorisk erytroblastopeni, Diamond-Blackfans anemi og andre benmargssvikttilstander. Ved debut etter første leveår ser man som oftest en redusert tilvekst på vekstkurvene. Hos ca. halvparten av pasientene finner man ulike anomalier (kraniofacielle-, øye-, urogenitale-, muskel- og skjelett- og hjerte-anomalier) og mange har karakteristiske ansiktstrekk (7–9). Ved patogene varianter i RPL11-genet er tommelanomalier spesielt hyppig (hypoplastisk tenarmuskulatur, trifalangeal eller bifid tommel) (10). Mer enn 20 ulike gener er assosiert med Diamond-Blackfans anemi, og arvegangen er overveiende autosomal dominant. Patogene varianter leder til redusert produksjon av ribosomale proteiner som medfører en p53-indusert apoptose av den erytroide differensieringen som svar på nukleolært stress. Hos om lag 45 % er genfeilen nyoppstått hos den syke, mens resten har arvet varianten fra en forelder som ikke behøver å ha manifestasjoner av tilstanden (9). Behandlingen av anemi ved denne tilstanden er regelmessige blodtransfusjoner, kortikosteroider (prednisolon) eller stamcelletransplantasjon (7, 11, 12). Ved symptomdebut i første leveår trenger mange barn transfusjoner hver 4. til 6. uke for å holde Hb-nivået mellom 9 og 11 g/dL. Målet med transfusjonene skal være å sikre vekst og god livskvalitet. Barn med denne tilstanden tåler lavt Hb-nivå nokså godt. Hos barn som er transfusjonskrevende, forsøker man gjerne prednisolon etter første leveår, og ved tilstrekkelig respons trapper man gradvis ned til minste dose som holder et akseptabelt Hb-nivå med samtidig adekvat lengdevekst. De fleste responderer på kortikosteroider, og man ser innen få uker en stigning i retikulocytter som tegn på behandlingsrespons. Dersom barnet ikke responderer på steroider, har intolerable bivirkninger (som uttalt påvirkning av lengdevekst) eller steroiddoseringen er jevnt høy, må man igjen gå over til regelmessige transfusjoner. Pasienter med Diamond-Blackfans anemi har en økt risiko for jernopphopning selv uten transfusjoner, og de som transfunderes regelmessig, trenger jernkelerende behandling fra ung alder. Stamcelletransplantasjon kan tilbys pasienter som har et kronisk transfusjonsbehov. Best resultater har tradisjonelt vært oppnådd ved bruk av søskengivere og ved transplantasjon før tiårsalderen, men i nyere tid har man også gode resultater ved ubeslektet donor (12). Behandling med aminosyren L-leucin gitt til barn med Diamond-Blackfans anemi, kan øke vekt og veksthastighet hos noen av pasientene, mens hematologisk respons ble observert hos en mindre gruppe (13). Den foreslåtte mekanismen er at L-leucin oppregulerer translasjon av budbringer-RNA (mRNA), som potensielt kan forbedre både svikt i erytropoesen og veksthemmingen hos disse pasientene. Vår pasient hadde ingen effekt av denne behandlingen. Genterapi ved tilstanden er foreløpig ikke tilgjengelig.
Tabell 1
Diagnostiske kriterier for Diamond-Blackfans anemi. Dersom alle kriterier er oppfylt, kan diagnosen «klassisk» Diamond-Blackfans anemi stilles. Ved «ikke-klassisk» Diamond-Blackfans anemi kan diagnosen mistenkes med økende sannsynlighet basert på antall hoved- og støttekriterier som oppfylles (8).
| Hovedkriterier: | ||
|---|---|---|
| Alder < 1 år | ||
| Makrocytær anemi uten andre ledsagende cytopenier | ||
| Retikulocytopeni | ||
| Normocellulær benmarg med få erytroide forstadier | ||
| Støttekriterier: | ||
| Major | Kjent genmutasjon assosiert med klassisk Diamond-Blackfans anemi | |
| Positiv familiehistorie | ||
| Minor | Forhøyet erytrocyttadenosindeaminase (eADA) | |
| Medfødte misdannelser beskrevet ved klassisk Diamond-Blackfans anemi | ||
| Forhøyet nivå av føtalt hemoglobin (HbF) | ||
| Andre medfødte benmargssviktsyndromer avkreftet | ||
Noen barn med Diamond-Blackfans anemi kan oppleve en gradvis normalisering av Hb-nivået, og et mindretall går i en spontan og varig remisjon (13–20 %), mulig som følge av selektiv vekstfordel av somatiske mutasjoner i beinmarg som har tapt den sykdomsgivende mutasjonen («revertant somatic mosaicism») (14).
Barn med denne tilstanden må følges opp regelmessig og tverrfaglig i spesialisthelsetjenesten pga. risiko for assosierte/sekundære tilstander. Sekundært til jernopphopning, jernkelerende behandling og steroidbehandling er det viktig med regelmessig kardiologisk, audiologisk, oftalmologisk og endokrinologisk oppfølging. I tillegg må pasientene følges hematologisk, uavhengig om de transfunderes eller ikke, og det bør være lav terskel for benmargsundersøkelser pga. økt risiko for utvikling av myelodysplastisk syndrom og leukemi (7). Pasienter med Diamond-Blackfans anemi har også økt risiko for solide svulster (brystkreft, hepatocellulært karsinom og ben- og bløtvevssarkomer), men denne risikoen gjør seg oftest først gjeldende i voksen alder (7–9). Det er per i dag ikke anbefalt rutinemessig tumorscreening, men lav terskel for videre undersøkelser ved symptomer som kan være forenlige med malign sykdom (7, 11). For jenter med tilstanden kreves det ekstra oppfølging i svangerskapet pga. økt risiko for komplikasjoner, inkludert dødfødsel, preeklampsi og intrauterin vekstretardasjon (7, 15). Hos alle er det viktig å tilby genetisk veiledning.
Vår pasient hadde lett underutviklet tenarmuskulatur, og rapporterte om redusert gripekraft og lettere krampedannelse i hendene. Utover dette hadde han ingen observerbare anomalier eller avvikende ansiktstrekk. Han utviste fin tilvekst gjennom barndommen, og hans alvorlige, normokrome anemi i tidlig barnealder rettet seg med ledsagende retikulocytose, noe som passet godt med transitorisk erytroblastopeni. Hb-nivået normaliserte seg imidlertid aldri helt. Pasienten var et aktivt barn, og etter hvert en ungdom som trente mye. Gjentagende benmargsprøver fremviste ikke de mer typiske tegnene ved Diamond-Blackfans anemi med redusert antall erytroide forstadier. Det tok lang tid før diagnosen ble etablert, behandling tilbudt og rett oppfølging startet. Dersom man hadde mistenkt benmargssvikt allerede ved første presentasjon i tidlig barnehagealder, kunne måling av erytrocyttadenosindeaminase og føtal Hb potensielt ha bidratt til at rett diagnose ble stilt tidligere, selv om disse parameterne også kan være normale ved denne tilstanden. Pasienten er et godt eksempel på at det er et bredt fenotypisk spekter ved Diamond-Blackfans anemi og at ikke alle med denne tilstanden presenterer symptomene på den klassiske måten i første leveår. Ved kronisk makrocytær anemi uten klar årsak må man derfor tenke på denne tilstanden hos barn. Likeledes må man også vurdere denne tilstanden hos voksne pasienter uten familiehistorie og de ledsagende kjente anomaliene, særlig med tanke på den økte kreftrisikoen og muligheten for genetisk veiledning.
Pasienten (og foresatte) har gitt samtykke til at artikkelen blir publisert.
Artikkelen er fagfellevurdert.
- 1.
Kassebaum NJ, Jasrasaria R, Naghavi M et al. A systematic analysis of global anemia burden from 1990 to 2010. Blood 2014; 123: 615–24. [PubMed][CrossRef]
- 2.
Helsebiblioteket. Generell veileder i pediatri. 9.2.1 Jernmangelanemi. https://www.helsebiblioteket.no/innhold/retningslinjer/pediatri/generell-veileder-i-pediatri/9.hematologi-og-onkologi/9.2-anemier/9.2.1-jernmangelanemi#-helsebiblioteket-innhold-retningslinjer-pediatri-generell-veileder-i-pediatri-9hematologi-og-onkologi-92-anemier-921-jernmangelanemi Lest 22.6.2022.
- 3.
van den Akker M, Dror Y, Odame I. Transient erythroblastopenia of childhood is an underdiagnosed and self-limiting disease. Acta Paediatr 2014; 103: e288–94. [PubMed][CrossRef]
- 4.
Helsebiblioteket. Akuttveileder i pediatri. 9.1 Akutt anemi. https://www.helsebiblioteket.no/innhold/retningslinjer/pediatri/akuttveileder-i-pediatri/9.hematologi-og-onkologi/9.1-akutt-anemi Lest 22.6.2022.
- 5.
UpToDate. Approach to the child with anemia. https://www.uptodate.com/contents/approach-to-the-child-with-anemia?search=anaemia&source=search_result&selectedTitle=2~150&usage_type=default&display_rank=2 Lest 22.6.2022.
- 6.
Green R, Datta Mitra A. Megaloblastic anemias: Nutritional and other causes. Med Clin North Am 2017; 101: 297–317. [PubMed][CrossRef]
- 7.
Da Costa L, Leblanc T, Mohandas N. Diamond-Blackfan anemia. Blood 2020; 136: 1262–73. [PubMed][CrossRef]
- 8.
Vlachos A, Ball S, Dahl N et al. Diagnosing and treating Diamond Blackfan anaemia: results of an international clinical consensus conference. Br J Haematol 2008; 142: 859–76. [PubMed][CrossRef]
- 9.
Da Costa LM, Marie I, Leblanc TM. Diamond-Blackfan anemia. Hematology (Am Soc Hematol Educ Program) 2021; 2021: 353–60. [PubMed][CrossRef]
- 10.
Quarello P, Garelli E, Carando A et al. Diamond-Blackfan anemia: genotype-phenotype correlations in Italian patients with RPL5 and RPL11 mutations. Haematologica 2010; 95: 206–13. [PubMed][CrossRef]
- 11.
Vlachos A, Muir E. How I treat Diamond-Blackfan anemia. Blood 2010; 116: 3715–23. [PubMed][CrossRef]
- 12.
Diaz-de-Heredia C, Bresters D, Faulkner L et al. Recommendations on hematopoietic stem cell transplantation for patients with Diamond-Blackfan anemia. On behalf of the Pediatric Diseases and Severe Aplastic Anemia Working Parties of the EBMT. Bone Marrow Transplant 2021; 56: 2956–63. [PubMed][CrossRef]
- 13.
Vlachos A, Atsidaftos E, Lababidi ML et al. L-leucine improves anemia and growth in patients with transfusion-dependent Diamond-Blackfan anemia: Results from a multicenter pilot phase I/II study from the Diamond-Blackfan Anemia Registry. Pediatr Blood Cancer 2020; 67: e28748. [PubMed][CrossRef]
- 14.
Biesecker LG, Spinner NB. A genomic view of mosaicism and human disease. Nat Rev Genet 2013; 14: 307–20. [PubMed][CrossRef]
- 15.
Faivre L, Meerpohl J, Da Costa L et al. High-risk pregnancies in Diamond-Blackfan anemia: a survey of 64 pregnancies from the French and German registries. Haematologica 2006; 91: 530–3. [PubMed]