En ung mann ble innlagt med akutt abdomen og tegn på pankreatitt. Sykdomsforløpet ble alvorlig, med en kirurgisk løsning på den underliggende medisinske årsaken.
En mann i midten av 20-årene ble innlagt på gastrokirurgisk avdeling etter ett døgns sykehistorie med måltidsrelaterte kolikksmerter under høyre kostalbue. Lignende smerteanfall var de siste to årene i primærhelsetjenesten blitt tolket som gallestenskolikk og behandlet med reseptfrie smertestillende midler. Pasienten brukte ingen faste medisiner eller kosttilskudd, hadde ingen allergier og angav et moderat alkoholbruk. Ved innkomst var pasienten afebril med stabile vitalia: regelmessig puls 86 slag/min, blodtrykk 136/86 mmHg, respirasjonsfrekvens 26 pust/min og 100 % oksygenmetning. Pasienten var medtatt og hadde opioidkrevende smerter. Hud og sklera var tydelig ikteriske. Ved kroppslig undersøkelse var bukmuskulaturen spent, og pasienten var palpasjonsøm under høyre kostalbue og i epigastriet. Øvrig organundersøkelse var upåfallende.
Anamnese og klinisk bilde ble tolket som gallestensutløst kolikk med sekundært begynnende kolecystitt eller kolangitt, og pasienten ble henvist til avklarende ultralydundersøkelse av lever, galle og pankreas som øyeblikkelig hjelp.
Mistanken ble styrket da orienterende blodprøver tatt ved innleggelse viste hemoglobin på 16,1 g/dL (referanseområde 13,2–16,5) og gjennomsnittlig cellevolum i de røde blodcellene (MCV) på 82 fL (83–97). Det forelå betydelig leukocytose med leukocyttall 40,3 × 109/L (3,9–9,8 × 109) og normal CRP 1,6 mg/L (0–7). Bilirubin var 201 µmol/L (5–25), ALAT 84 U/L (10–70), LD 301 U/L (103–213) og gamma-GT 226 U/L (10–80). Det var forhøyet serumnivå av lipase på 13 281 U/L (4,1–71). Videre avdekket ultralydundersøkelse konkrementer i galleblæren og utvidelse av ductus choledochus (8 mm, på nivå med caput pancreatis, normalområde ≤ 6 mm) samt avkapslete væskeansamlinger i øvre høyre kvadrant av buken, noe som gav mistanke om pankreatitt.
Diagnosen akutt pankreatitt stilles når minst to av tre følgende kriterier er oppfylt: akutt, vedvarende smerte i epigastriet, ofte med utstråling til rygg; forhøyet nivå av lipase eller amylase i serum (mer enn tre ganger øvre referanseverdi); typiske funn ved billeddiagnostikk (CT, MR, ultralyd) (1). I dette tilfellet var alle tre kriterier oppfylt, og pasienten ble innlagt på gastrokirurgisk avdeling med mistanke om akutt gallestensutløst pankreatitt. Det ble iverksatt væskebehandling og lagt plan for adekvat smertelindring. Grunnet klinisk ikterus samt forhøyete nivåer av gamma-GT og bilirubin – som indikerer gallestase – ble det utført magnetisk resonanskolangiopankreatografi (MRCP), ettersom det ikke forelå feber eller tegn til bakteriell infeksjon. MRCP-undersøkelse ble funnet indisert for avklaring av konkrement i dype galleveier, før eventuelt endoskopisk avlastning av en gallegangsobstruksjon.
MRCP-undersøkelse samme dag viste peripankreatiske væskeansamlinger og et 4 mm stort konkrement distalt i ductus choledochus (figur 1). I tillegg forelå uttalte pankreatittforandringer med omkringliggende ødem og væskeansamlinger i øvre abdomen. Tredje dag etter innleggelsen var pasienten ytterligere medtatt og smertepåvirket samt plaget av kvalme. Blodprøver viste vedvarende leukocytose på 45,6 × 109/L. CRP-nivået hadde økt til 261 mg/L, og bilirubinnivået hadde steget videre til 290 µmol/L. Det ble startet bredspektret, intravenøs antibiotikabehandling i form av piperacillin/tazobaktam 4 g/0,5 g tre ganger daglig på mistanke om samtidig infeksjon i galleveier. Videre ble pasienten henvist til endoskopisk retrograd kolangiografi (ERC), som ble utført ukomplisert med papillotomi fulgt av fjerning av to sorte konkrementer i distale choledochus. Galleblæren var pakket med konkrementer ved kolangiografi. Det ble i etterkant samme dag målt bilirubinnivå fallende til 139 µmol/L.
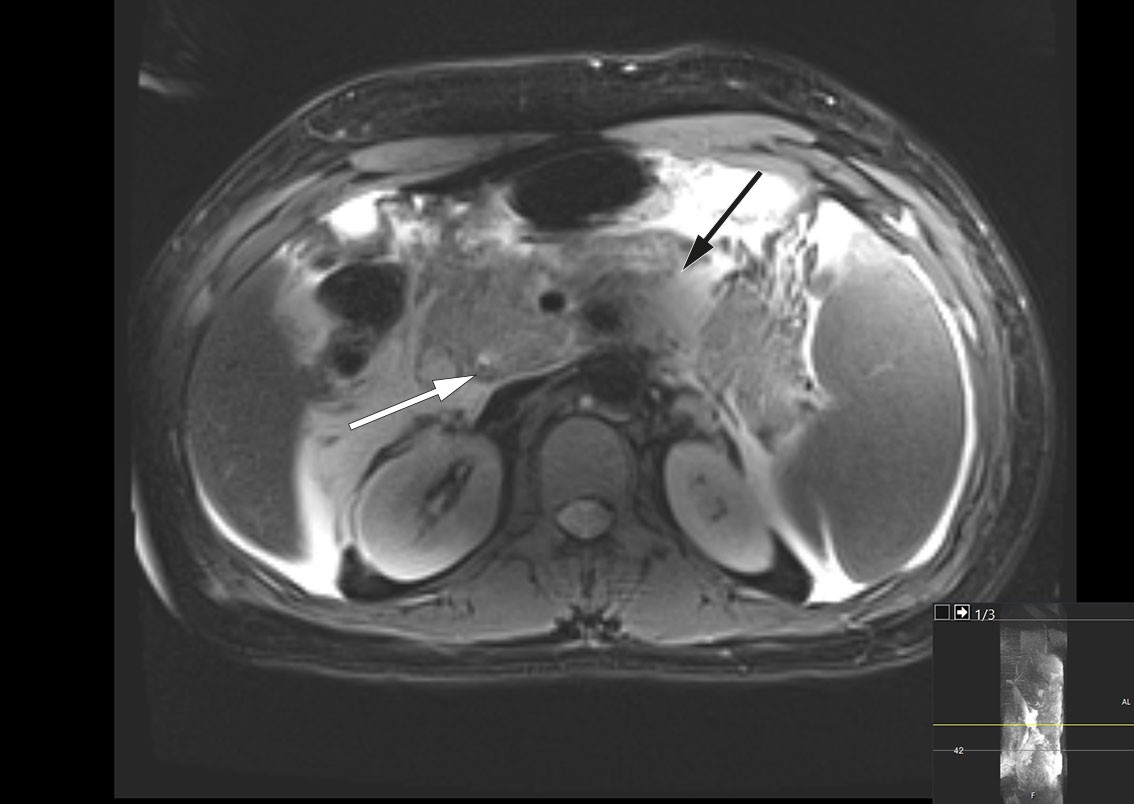
Viktige differensialdiagnoser til akutt, biliær pankreatitt er steinsykdom i galleveiene, som fører til infeksjon, spesielt akutt kolangitt. Selv om antibiotikabehandling ikke er indisert ved akutt pankreatitt, vil akutt kolangitt kreve antibiotika, sanering og avlastning av galleveier som prioritert behandling. Man oppfattet at pasienten hadde akutt biliær pankreatitt med tillegg av en akutt kolangitt, som krevde rask avlastning.
Pasienten ble samme dag etter ERC-undersøkelsen febril med temperatur 38,4 °C og tiltakende takykard med puls 110–130 slag/min. Videre tilkom økende oksygenbehov med 1–2 L O2 på nesekateter for å holde SpO2 > 95 %. Det var ikke behov for behandling med vasopressor, men pasienten fikk anlagt urinkateter grunnet intensiv intravenøs væskebehandling med totalt 5 000 mL Ringer-acetat, hvorpå diuresen ble målt til 40–50 mL/t. I lys av klinisk forverring ble pasienten det kommende døgnet fortsatt overvåket på postoperativ avdeling.
Akutt pankreatitt har et mildt, selvbegrensende forløp i nær 80 % av tilfellene, hvor symptomlindring og væskebehandling er viktigste behandlingsfokus (2). Følgelig kan nær ett av fem tilfeller med akutt pankreatitt få et mer fulminant og alvorlig forløp, hvor tettere overvåking av vitale funksjoner er nødvendig. Dette ble initiert i løpet av tredje døgn på postoperativ avdeling, da det ikke var egen kirurgisk intermediæravdeling på sykehuset.
Den kliniske tilstanden ble i løpet av tredje døgn ytterligere forverret med sterke magesmerter. Pasienten ble overflyttet til intensivavdeling grunnet begynnende organsvikt med O2-behov. Pasienten var somnolent, men selvpustende, og i behov av 2–3 L O2 på nesekateter for å opprettholde adekvat oksygenmetning > 92 %. Videre forelå stigende INR-verdi på 1,9 samt fallende albuminverdi på 22 g/L (fra 45,6 g/L), som ga mistanke om blødningsforstyrrelse. I tillegg tilkom ny stigning i bilirubinnivå til 290 µmol/L, men i fravær av øvrig stigende nivå av lever- og galleprøver ble behov for ny ERC-undersøkelse avventet etter tverrfaglig diskusjon. Ytterligere diagnostikk med CT av abdomen og bekken viste nekrotiserende pankreatitt med peripankreatiske væskeansamlinger samt fri væske i buken (figur 2). Det var ingen tegn til intra- eller ekstrahepatisk kolestase. Videre forelå bilateral pleuravæske og sammenfalt lungevev, som kunne forklare pasientens respiratoriske forverring. I lys av forhøyet INR-verdi ble det avstått fra pleuratapping. I tillegg ble det bemerket forstørret milt (største lengde 21 cm).
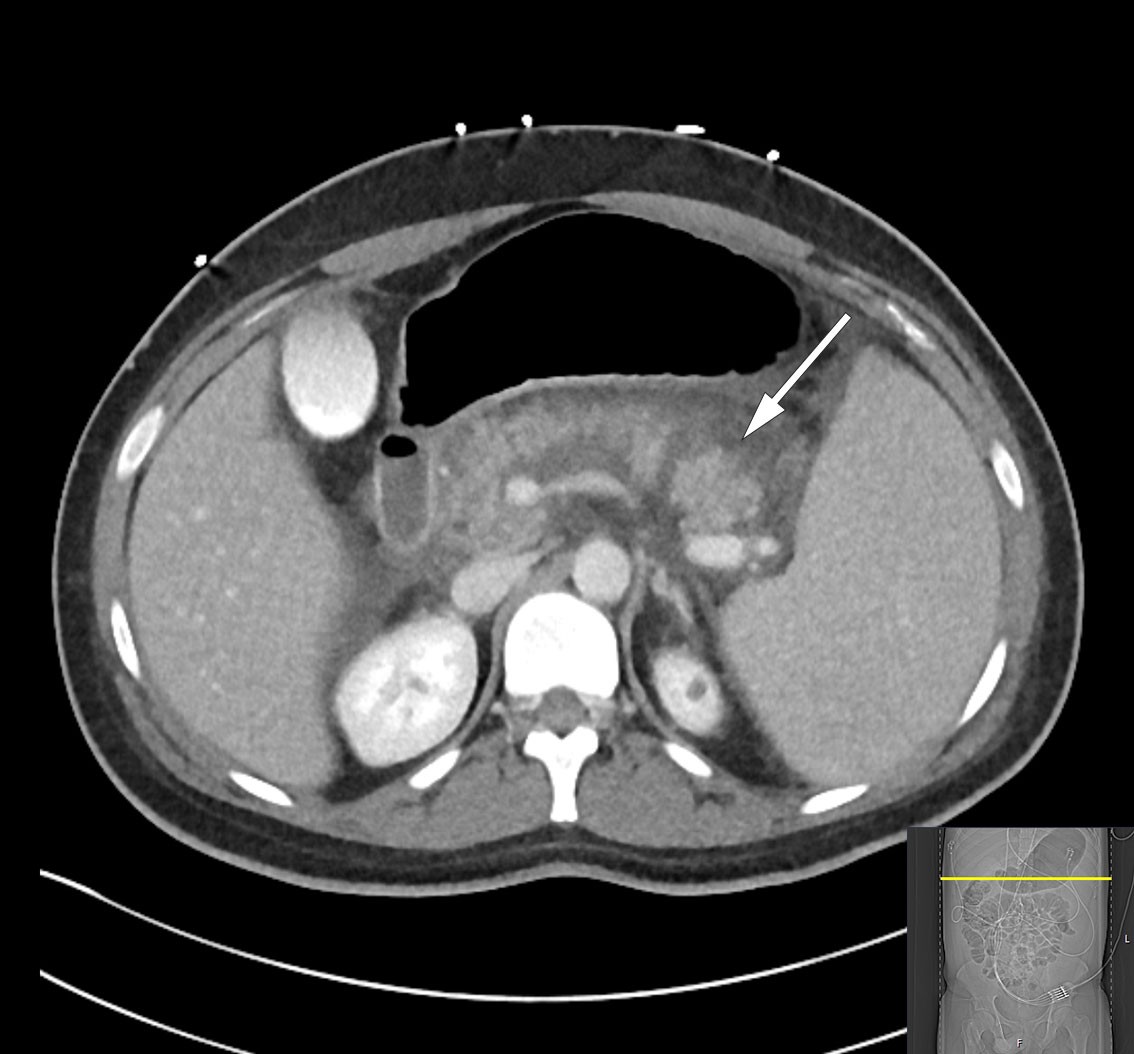
Nekrotiserende pankreatitt er en fryktet utvikling ved akutt pankreatitt, og oftest forbundet med et langvarig og alvorlig klinisk forløp. Nekrose i pankreasparenkym eller peripankreatisk vev oppstår i 5–10 % av pankreatittilfellene, og begrenser seg sjelden kun til pankreas (1). Sekundær infeksjon av nekroser grunnet translokasjon av bakterier fra gastrointestinaltraktus er ikke uvanlig, men oppstår sjelden den første uken. Mistanke om infeksjon gjør seg særlig gjeldende ved synlig ekstraluminal gass i pankreas eller omkringliggende vev på CT, hvorpå det bredspektret antibiotikabehandling er indisert. Intervensjon i form av nekrosektomi for fjerning av dødt vev er aktuelt først tre–fire uker ut i forløpet, hvor man forsøker en stegvis strategi med økende grad av invasivitet (3).
På grunn av restriksjoner under covid-19-pandemien hadde det vært begrenset besøk fra pårørende. Imidlertid ble det, i forbindelse med overføring til intensivavdeling, opprettet telefonisk kontakt fra behandlende overlege i gastrokirurgi. En fikk da komparentopplysninger hvor det kom frem at slektninger av pasienten hadde sfærocytose.
Splenomegali er et uspesifikt tegn med flere underliggende årsaker (4). Hereditær sfærocytose har i 75 % av tilfellene autosomal dominant arvegang og er den vanligste arvelige hemolytiske anemiformen i Nord-Europa (5). De ulike genvariantene har svært varierende klinisk penetrans, fra transfusjonskrevende neonatal ikterus fra fødselen til symptomfrihet gjennom hele livet. Det er ikke uvanlig at symptomer på sfærocytose først gjør seg gjeldende ved interkurrent eller akutt sykdom. Pasientens blodprøver viste hyperbilirubinemi av blandet type (totalt bilirubinnivå 478 µmol/L (5–25) og konjugert bilirubinnivå 350 µmol/L (< 4)) forårsaket av gallestase og mistenkt hemolyse. Sistnevnte var ikke utvetydig, grunnet normalisering av lett forhøyet nivå av laktatdehydrogenase (371 U/L, bemerket interferens grunnet høy bilirubin) og normalt nivå av haptoglobin. Gallesten i ung alder og familieanamnese talte derimot for kronisk hemolyse sekundært til sfærocytose. Det ble utført direkte antiglobulintest for å utelukke autoimmun hemolyse, hvorpå mistanken om sfærocytose ble bekreftet ved immunfenotyping med flowcytometri. Hematolog tilrådet på bakgrunn av dette at det på sikt skulle utføres en splenektomi.
Pasienten ble overvåket i fire døgn på intensivavdeling. Han ble smertelindret med epiduralanalgesi. ERC-undersøkelse ble gjentatt, med anleggelse av stent i choledochus for å sikre drenasje i tilfelle migrerende konkrementer. Til tross for dette forelå forbigående stigende nivå av bilirubin til 399 µmol/L, grunnet hemolyse med fallende hemoglobinnivå fra 12,6 g/dL til 9,4 g/dL i løpet av oppholdet på intensivavdelingen.
Pasienten ble gradvis bedre og ble utskrevet etter 18 dager, men ble 3 dager senere reinnlagt på grunn av tiltakende smerter og tungpust. Kontroll-CT påviste avkapsling av peripankreatiske nekrotiske væskeansamlinger, med delvis avklemming av port- og miltvenen. Det var ingen kolestase, og lett avtakende fri væske i bukhulen. Blodprøver viste tegn til betennelse, og det ble startet peroral antibiotikabehandling i form av trimetoprim/sulfametoksazol 160 mg/800 mg, to ganger daglig, samt metronidazol 400 mg tre ganger daglig, på mistanke om sekundærinfiserte nekroser. Pasienten kunne åtte dager etter andre innleggelse utskrives til eget hjem uten videre antibiotikabehandling. Det ble påfølgende uke planlagt endoskopisk transgastrisk drenasje av innkapslede nekrotiske væskelommer, såkalt walled-off necrosis (WON), grunnet avklemming av port- og miltvenen.
Tre dager etter andre utskrivelse ble pasienten på ny innlagt med økende smerter i venstre del av abdomen, strålende til rygg. Blodprøver viste leukocytose med leukocyttall 28,1 × 109/L og CRP 7,6 mg/L. Det forelå lett redusert nivå av hemoglobin på 12,4 g/dL samt forhøyet nivå av bilirubin på 53 µmol/L. Lipasenivået var på 81 U/L og minimalt forhøyet. Natt til tredje dag etter reinnleggelse var pasienten normotensiv, men takykard med pulsfrekvens på 134 slag/min, respirasjonsfrekvens på 44 pust/min og oksygenmetning på 91 % på romluft. Han var blek og klam og smertepåvirket med overflatisk respirasjon. Gjentatt CT-diagnostikk viste økende ascites, men avtakende størrelse på største væskelokulament. Det var ingen gallegangsdilatasjon, men det var tilkommet basale lungefortetninger på venstre side samt små mengder pleuravæske. Sistnevnte er ikke uvanlig i lys av pankreas' lokalisasjon opp mot diafragma, hvor inflammasjonsforandringene kan være utbredte og affisere lungehulen. Biokjemisk forelå forhøyete inflammasjonsprøver, med leukocytter på 22,5 × 109/L og CRP på 51 mg/L samt fallende hemoglobin på 10,6 g/dL. Pasienten ble bestemt overflyttet til intensivavdeling for optimalisering av smertelindring med epiduralkateter samt henvist til fremskyndet drenasje av innkapslet nekrose.
Neste dag var pasienten febril med temperatur 38,5 °C, men uten behov for oksygen. Innkapslet nekrose ble behandlet med anleggelse av en lumen-apposing metal stent (LAMS) av typen Hot AXIOS, et system utviklet for endoskopisk ultralydveiledet drenasje av innkapslet nekrose via magesekken. Videre ble det plassert ernæringssonde i tynntarmen, og pasienten startet med næringstilskudd. Påfølgende dager opplevde pasienten et svingende forløp, både klinisk og biokjemisk. Det ble startet bredspektret, intravenøs antibiotikabehandling i form av meropenem 1 g tre ganger daglig grunnet stigende CRP på 148 mg/L. Videre falt hemoglobinnivået til 6,9 g/dL, og pasienten ble besluttet transfundert med tre poser erytrocyttkonsentrat. CT-kontroll viste derimot betydelig redusert størrelse av den innkapslede nekrosen etter anlagt stent, og kompresjon av kar hadde opphørt (figur 3). Pasienten fikk utført nekrosektomi ved gastroskopi, hvor det ble fjernet større mengder dødt vev. Over de kommende dagene ble pasienten gradvis mobilisert, med samtidig bedret respirasjon og god diurese støttet av slyngediuretika. Det forelå sterile blodkulturer i to sett, men oppvekst av Staphylococcus epidermidis i urin av usikker klinisk betydning. Epiduralkateter ble seponert, opioider kunne nedtrappes i takt med økt mobilisering, og pasienten ble overflyttet til gastrokirurgisk sengepost dag 10 etter tredje reinnleggelse.
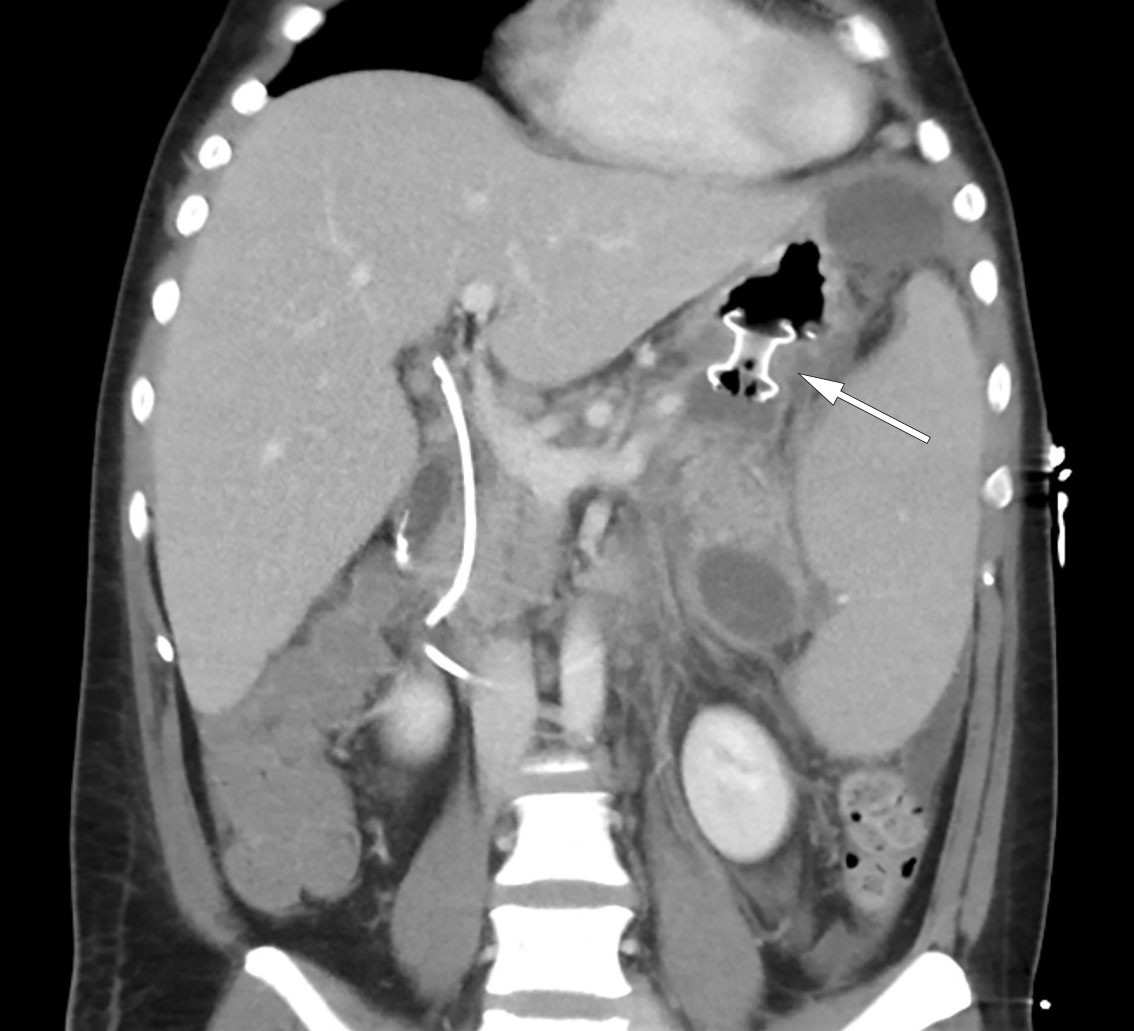
Pasienten opplevde gradvis bedring. På dag 25 ble Hot AXIOS-stenten fjernet uten komplikasjoner, og pasienten kunne utskrives på dag 29 etter tredje innleggelse. Han var da smertefri, med bløt og uøm buk. Videre var han fullt mobilisert og opprettholdt et normalt kosthold. Det forelå upåfallende inflammasjonsprøver samt lett anemi med hemoglobin på 9,2 g/dL. Han ble utstyrt med resept på protonpumpehemmer, pankreasenzymer og folsyre (konsentrasjonen av sistnevnte er ofte lav ved kronisk hemolyse). Tidligere plan om kolecystektomi og splenektomi i kald fase ble opprettholdt. CT av pankreas to uker etter hjemreise viste ingen restforandringer etter pankreatitt, men vedvarende splenomegali. Endoskopisk fjerning av gallestent forløp ukomplisert to måneder etter utskrivelse.
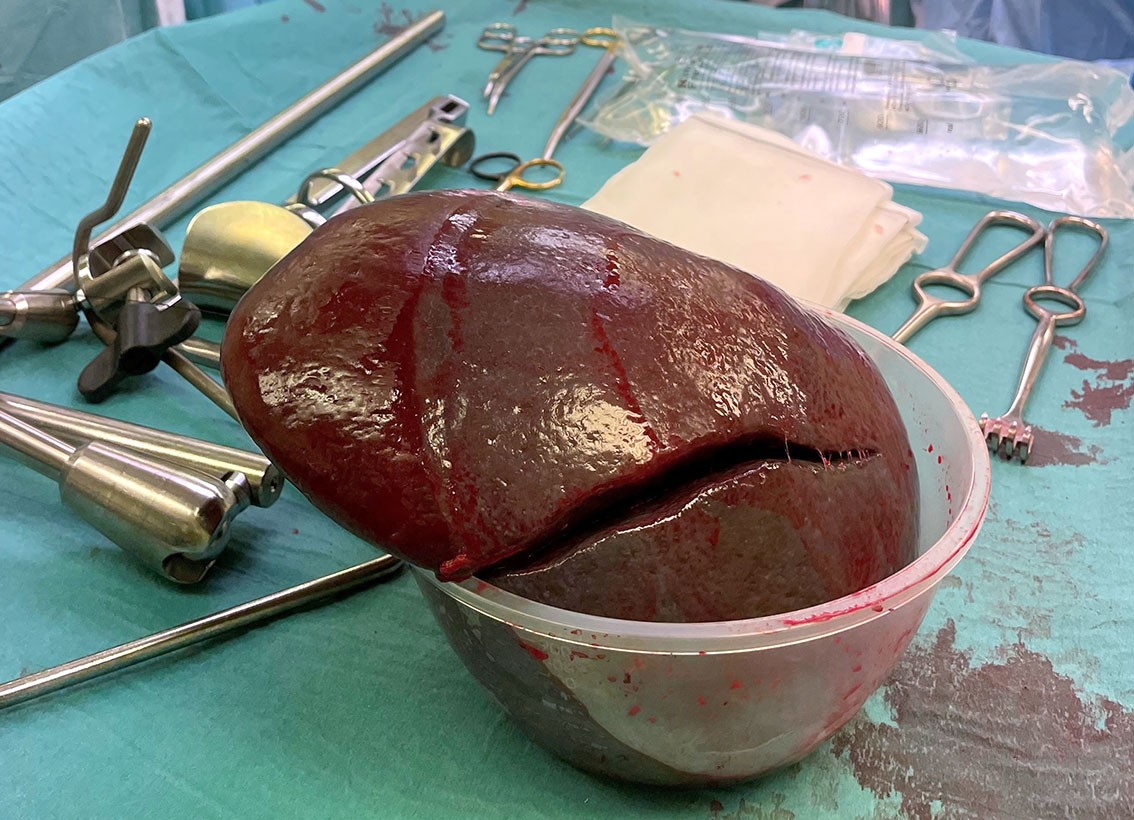
Pasienten ble innlagt for operativ behandling etter fire måneder. Det forelå forhøyet nivå av bilirubin på 81 µmol/L, men øvrige blodprøver var innenfor referanseområdene. Det ble påbegynt laparoskopisk kolecystektomi og splenektomi, men prosedyren var teknisk vanskelig grunnet sammenvoksinger og en svært stor milt. Sistnevnte ble derfor løsnet nesten fullstendig laparoskopisk, før inngrepet ble konvertert til åpen kirurgi. Total blødning var på 1 000 mL, hvorav en stor del som siving fra milten. Miltpreparatet veide 1 609 g (normal vekt er 120–200 g) (figur 4). Senere histologisvar viste ingen atypi, men et bifunn av godartet lymfangiom. Det postoperative forløpet var ukomplisert, og pasienten ble utskrevet på åttende postoperative dag. Videre vaksinasjon som post-splenektomi-profylakse ble planlagt etter gjeldende retningslinjer, og pasienten ble henvist til kontroll ved hematologisk avdeling for sin grunnlidelse (6).
Pasienten er åtte måneder etter operasjon i velbefinnende. Det er lav risiko for hemolytisk anemi etter splenektomi, også ved interkurrent sykdom, og det er derfor ikke planlagt videre kontroll. Pasienten er derimot tilbudt genetisk veiledning grunnet mistanke om hereditær sfærocytose.
Diskusjon
Akutt pankreatitt er en alvorlig inflammatorisk tilstand i pankreas (7). Tilstanden kan være livstruende, men de fleste opplever et forbigående, mildt forløp. Insidensen varierer geografisk og er i Norge 30,6 per 100 000 innbyggere (8). Alvorlig sykdom oppstår hos 20 % av pasientene, med fatalt utfall i 20–30 % av tilfellene (9). Total mortalitet er 3 %. Etiologien er mangfoldig, men den vanligste utløsende årsaken er gallesten, dernest alkoholbruk, og til sammen står disse for 70–80 % av tilfellene. Behandlingen består i hovedtrekk av intravenøs væsketilførsel, smertelindring og ernæringsstøtte, men kan ved nekrotiserende pankreatitt inkludere nekrosektomi for fjerning av dødt vev ved endoskopi. Slik behandling skjer først etter fire uker, for å gi nekrosene tid til å «modne» og bli innkapslet.
Foruten gallesten og alkohol kan en rekke andre tilstander forårsake pankreatitt, hvorav alle er å anse som uvanlige. I dette tilfellet var årsaken gallesten sekundært til en hemolytisk anemi forårsaket av hereditær sfærocytose (5) (figur 5). Sfærocytose innebærer en defekt i membranen til de røde blodcellene som gjør at de utvikler en sfærisk form og blir til såkalte sfærocytter. Dette gir cellene nedsatt elastisitet som forhindrer normal passasje gjennom kapillarene. Videre fjernes de røde blodcellene i økt grad fra sirkulasjonen av makrofager i milten, som gjenkjenner sfærocyttene som defekte. Over tid utvikles hypersplenisme med videre økt destruksjon av røde blodceller og påfølgende kronisk anemi. Sykdomsgraden er derfor relatert til andelen sfærocytter i blodet. Videre medfører nedbrytingen av hem i hemoglobinet økte nivåer av bilirubin, som fører til utkrystallisering av biliære gallestenskonkrementer i galleblæren. Disse vandrer så ut i galletreet og kan medføre gallestenskolikk, som ofte er selvbegrensende idet konkrementet passerer ut i duodenum.
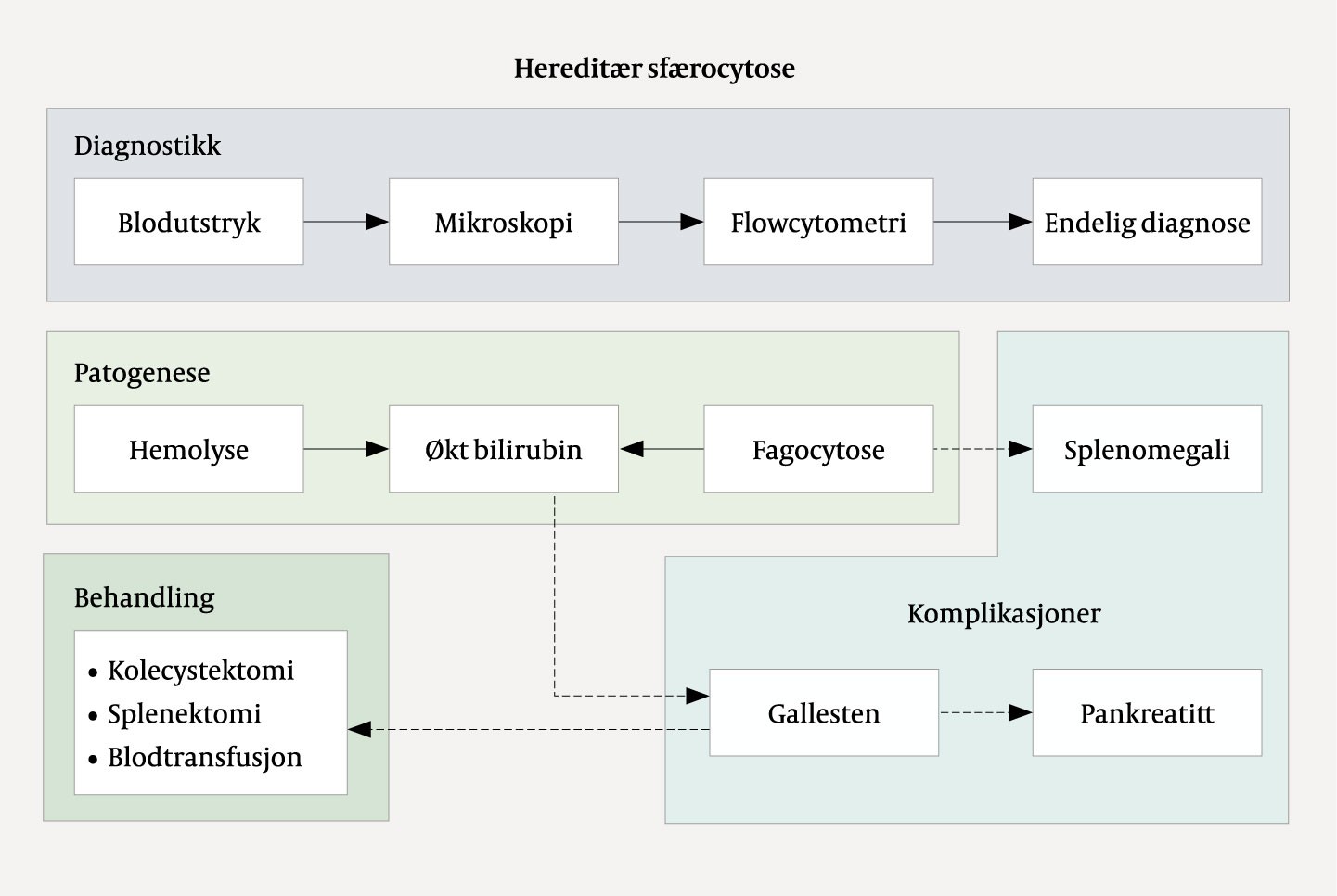
Mekanismen som ligger til grunn for at passasjen av gallestener medfører pankreatitt, er ukjent, men antas å være relatert til forbigående eller vedvarende gallestase forårsaket av migrerende eller fastkilt konkrement i gallegangen, eller å være relatert til papillen i duodenalveggen. Begge årsakene støttes av betydelig redusert risiko for residiv ved kolecystektomi og sanering av konkrementer i galleveiene (10, 11). Endelig behandling i dette tilfellet var operativ. Dersom en pasient med sfærocytose er mildt plaget av anemi og gallestener, vil splenektomi være tilstrekkelig, men ved for eksempel gjennomgått biliær pankreatitt vil det være klar indikasjon for kolecystektomi for å unngå residiv. Det beste er at risikoen erkjennes i forkant av symptomutvikling, hvor informasjon om hereditet vil være avgjørende. I dette tilfellet ville jevnlig oppfølging fra barneår, med senere kolecystektomi og splenektomi i profylaktisk henseende, trolig forhindret pasientens alvorlige sykdomsforløp.
Akutt pankreatitt er en vanlig tilstand på en gastrokirurgisk avdeling, og brorparten er forårsaket av gallesten og alkohol. Hereditær sfærocytose er den vanligste av de arvelige hemolytiske anemiene, men en sjelden årsak til gallestensutløst pankreatitt. Alvorlig ikterus som ikke bedret seg til tross for initial gallegangssanering og avlastning, pekte på annen underliggende årsak til høy bilirubinverdi. Sfærocytose må mistenkes ved samtidig anemi, hereditet og fravær av andre utløsende årsaker til pankreatitt.
Pasienten har gitt samtykke til at artikkelen blir publisert.
Artikkelen er fagfellevurdert.
- 1.
Banks PA, Bollen TL, Dervenis C et al. Classification of acute pancreatitis–2012: revision of the Atlanta classification and definitions by international consensus. Gut 2013; 62: 102–11. [PubMed][CrossRef]
- 2.
Mofidi R, Duff MD, Wigmore SJ et al. Association between early systemic inflammatory response, severity of multiorgan dysfunction and death in acute pancreatitis. Br J Surg 2006; 93: 738–44. [PubMed][CrossRef]
- 3.
Trikudanathan G, Wolbrink DRJ, van Santvoort HC et al. Current Concepts in Severe Acute and Necrotizing Pancreatitis: An Evidence-Based Approach. Gastroenterology 2019; 156: 1994–2007.e3. [PubMed][CrossRef]
- 4.
Pozo AL, Godfrey EM, Bowles KM. Splenomegaly: investigation, diagnosis and management. Blood Rev 2009; 23: 105–11. [PubMed][CrossRef]
- 5.
Perrotta S, Gallagher PG, Mohandas N. Hereditary spherocytosis. Lancet 2008; 372: 1411–26. [PubMed][CrossRef]
- 6.
Kuchar E, Miśkiewicz K, Karlikowska M. A review of guidance on immunization in persons with defective or deficient splenic function. Br J Haematol 2015; 171: 683–94. [PubMed][CrossRef]
- 7.
Boxhoorn L, Voermans RP, Bouwense SA et al. Acute pancreatitis. Lancet 2020; 396: 726–34. [PubMed][CrossRef]
- 8.
Gislason H, Horn A, Hoem D et al. Acute pancreatitis in Bergen, Norway. A study on incidence, etiology and severity. Scand J Surg 2004; 93: 29–33. [PubMed][CrossRef]
- 9.
Petrov MS, Shanbhag S, Chakraborty M et al. Organ failure and infection of pancreatic necrosis as determinants of mortality in patients with acute pancreatitis. Gastroenterology 2010; 139: 813–20. [PubMed][CrossRef]
- 10.
van Baal MC, Besselink MG, Bakker OJ et al. Timing of cholecystectomy after mild biliary pancreatitis: a systematic review. Ann Surg 2012; 255: 860–6. [PubMed][CrossRef]
- 11.
McAlister VC, Davenport E, Renouf E. Cholecystectomy deferral in patients with endoscopic sphincterotomy. Cochrane Database Syst Rev 2007; 2007: CD006233. [PubMed][CrossRef]