Background.
Treatment of rectal cancer with total mesorectal excision has changed the national strategy for treatment of this condition during the last 15 years. The aim of this article was to describe contemporary standards of treatment for rectal cancer in Norway.
Material and methods.
Reports on treatment results from the Norwegian Rectal Cancer Project form the basis for this article.
Results and interpretation.
During the first six years (1993 – 1999) of the Norwegian Rectal Cancer Project; the rate of local recurrence was halfed (from 18 % to 9 %), the rate of anastomotic leakage decreased from 17 % to 8 % and radically operated patients (< 75 years) had a five-year overall survival rate of 71 %. Main factors for this improvement were most certainly implementation of total mesorectal excision, centralized treatment, establishing treatment teams of dedicated experts, improved preoperative work-up and tailored treatment.
Moderne forståelse av prinsippene for helbredende kirurgi for rectumcancer ble introdusert av den britiske kirurgen Richard Heald i 1982 (1). Healds resultater la grunnlaget for å starte et nasjonalt prosjekt for å bedre behandlingen av rectumcancer. Det var kjent at prognosen for norske pasienter var langt dårligere (21 – 34 % lokalt residiv) (2, 3) enn det Heald kunne vise til ved bruk av sin operasjonsteknikk (4 % lokalt residiv). Riktignok var det også rapportert om meget gode resultater fra et sykehus i Norge, publisert av Bjerkeset & Edna i Levanger (4). Høsten 1993 ble Heald invitert til Norge for å demonstrere sin kirurgiske teknikk, og han holdt en rekke kurs i perioden frem til 1998.
Utdanning av norske kirurger i den nye teknikken var bare ett av mange tiltak som ble iverksatt. Det ble opprettet et separat nasjonalt register for rectumcancer, lokalisert til Kreftregisteret. Dette registeret har senere gitt regelmessige tilbakemeldinger til hver enkelt avdeling om deres resultater, med nasjonale gjennomsnitt til sammenlikning.
Målet med denne artikkelen er å beskrive dagens standard for kirurgisk behandling av rectumcancer med utgangspunkt i det nasjonale prosjektet.
Materiale og metode
Grunnlagsmaterialet for artikkelen er i hovedsak basert på resultater av behandling av norske pasienter med rectumcancer. Data er hentet og skjønnsmessig inkludert fra internasjonale artikler og doktorgradsavhandlinger publisert fra det norske rectumcancerprosjektet siden 2002.
Utredning
Moderne kirurgisk behandling av rectumcancer blir skreddersydd i forhold til pasientens alder og allmenntilstand, svulstens stadium og strategier for pre- eller postoperativ onkologisk behandling. Preoperativ bildemessig utredning inkluderer CT av thorax og abdomen og MR av bekkenet.
Kirurgiske prosedyrer
Store inngrep
Lav fremre rectumreseksjon utføres hos ca. 70 % av pasientene som behandles med kurativ intensjon i Norge i dag (5). På grunn av faren for anastomosesvikt får 25 – 30 % av disse en avlastende ileostomi (6). Denne kan legges ned igjen i løpet av noen uker eller måneder. Vel 25 % av pasientene blir operert med rectumamputasjon fordi svulsten affiserer bekkenbunnsmuskulaturen, og knapt 5 % blir behandlet med Hartmanns operasjon (hvor sigmoideum legges ut som endestomi), enten fordi de har ileus eller ved inkontinens for avføring. Dette innebærer at om lag 30 % av norske pasienter med rectumcancer ender opp med permanent stomi (5).
Transanale inngrep
Lokale transanale reseksjoner har vært i bruk ved tidligcancer hos pasienter som er uegnet for stor kirurgi. Fordelen er at prosedyren gir lavere morbiditet og mortalitet sammenliknet med stor reseksjon. Likevel er inngrepet bare rettet inn mot å fjerne primærtumor, og lymfeknuter med eventuell malign infiltrasjon blir stående tilbake. Metoden anbefales derfor ikke der hvor man ellers har et kurativt siktemål hos pasienter som vil tåle en laparotomi. For øvrig kan adjuvant radiokjemoterapi gis til pasienter med tilfredsstillende allmenntilstand etter at primærtumor er fjernet transanalt. Transanal endoskopisk mikrokirurgi (TEM) er sannsynligvis det beste alternativet til å oppnå frie reseksjonskanter dersom lokal reseksjon er det eneste pasienten egner seg for (7) – (9).
Kirurgen som risikofaktor
Som i all virksomhet er det variasjoner i kvalitet av tjenestene som leveres ved sykehus. Dette gjelder også kreftbehandlingen. Forholdet mellom behandlingsvolum og kvalitet i behandlingen, for eksempel prognose ved kreftkirurgi, er vel dokumentert i tre større systematiske analyser; fra UK National Health Service Centre for Reviews and Dissemination (10, 11), fra Institute of Medicine i USA (12, 13) og fra det norske Senter for medisinsk metodevurdering (14). Alle disse konkluderer med at prognosen etter komplisert kreftbehandling er bedre for pasienter behandlet ved store avdelinger.
Resultatene fra det norske rectumcancerprosjektet bekreftet at pasienter som ble behandlet ved store sykehus (radikalopererte > 30 per år) kom bedre ut enn pasienter behandlet ved små sykehus (< 10 per år) (15). Det ble også vist at høyt behandlingsvolum alene ikke er tilstrekkelig for å oppnå god kvalitet. Fagmiljøets kompetanse er en like viktig faktor. Justert for volum var det bedre prognose for pasienter behandlet ved universitetsklinikker sammenliknet med andre sykehus (15).
En kanadisk studie viste at hos kirurger som ofte behandlet rectumcancer utviklet rundt 10 % av pasientene lokalt residiv, mens pasienter som ble operert av kirurger med lavere behandlingsvolum fikk lokalt residiv i 20 % av tilfellene (16). Prognosen for den enkelte pasient med rectumcancer synes således å henge sammen med kirurgenes kunnskap og erfaring.
Kirurgisk behandling
Tidlig cancer med infiltrasjon i submucosa (T1)
T1-svulster infiltrerer ned i submucosa, og ca. 11 % av disse har spredning til lokale eller regionale lymfeknuter (8). Imidlertid kan cancer i stadium T1 ytterligere inndeles i hvor dypt canceren infiltrerer i submucosa. I hovedsak benyttes to klassifiseringssystemer, en for stilkete polypper (etter Haggitt) (fig 1) (17) og en for bredbasede svulster (submukosal infiltrasjon, sm) (fig 2) (17, 18). Ved polypper der canceren ikke infiltrerer ned i stilken av polyppen (Haggitts nivå 1 – 2), kan det utføres slyngereseksjon, mens det ved kreftinnvekst i stilken eller under basis av stilken (Haggitts nivå 3 – 4) må utføres en reseksjon av rectumveggen som omgir stilken (19). Det anbefales 1 cm fri kant ved slik reseksjon, og frie kanter må verifiseres ved peroperativ frysesnittsundersøkelse av biopsier fra kantene (9). Det er sannsynligvis meget lav risiko for lymfeknutemetastaser ved cancer i smalstilkete polypper.
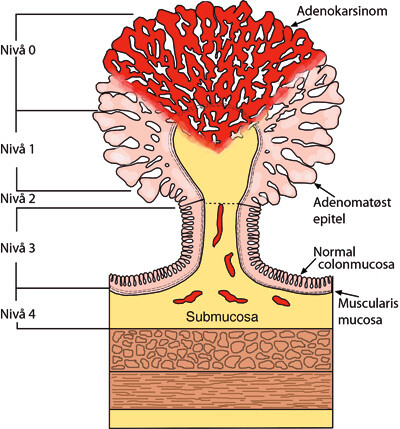
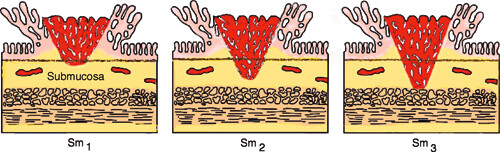
T1-cancer i bredbasede svulster bør inndeles etter sm-systemet (submukosal infiltrasjon 1 – 3) (fig 2) (19). Transanal endoskopisk mikrokirurgi (TEM) kan vurderes som alternativ behandling ved enkelte tilfeller av T1-cancer, men bare når risikoen for lymfeknutemetastaser er lav, som ved høyt eller middels differensierte svulster med diameter på mindre enn 3 cm, som ikke vokser dypere enn til midten av submucosa (sm 1 – 2) og uten at det er tegn til infiltrasjon i kar eller lymfebaner. Hvis disse kriteriene ikke er oppfylt, anbefales stor reseksjon. Slik differensiering av behandlingen stiller store krav til nøyaktig patologisk kartlegging av tumor ved mikroskopi (7). Behandling med transanal endoskopisk mikrokirurgi er teknisk krevende og er derfor sentralisert til enkelte universitetsklinikker.
Åpen transanal reseksjon har vært brukt som et alternativ hos pasienter som av helsemessige årsaker ikke egner seg for stor kirurgi (8). Hovedproblemet med denne metoden har vært å få fjernet hele primærsvulsten. I tillegg fjernes heller ikke lymfeknuter med eventuell malign infiltrasjon. Begge disse forhold har trolig medvirket til at transanal eksisjon har gitt hele 12 % lokale residiv hos norske pasienter som i utgangspunktet har kreft i tidlig stadium (T1) (8). Dette resultatet må likevel tolkes ut fra den standarden vi hadde i Norge i slutten av 1990-årene, uten bruk av moderne kriterier for patologisk anatomisk klassifisering. Det er likevel gode grunner for stadig å utvikle standarder for lokal reseksjon av T1-cancer, særlig transanal endoskopisk mikrokirurgi, da dette er et utmerket alternativ sett i forhold til den betydelige høyere morbiditet og 30-dagers mortalitet vi ser ved stor reseksjon. En annen fordel med lokal eksisjon er at pasienten unngår permanent stomi ved lavt beliggende T1-cancer, hvor rectumamputasjon er eneste alternativ.
Infiltrasjon i muscularis (T2-svulster)
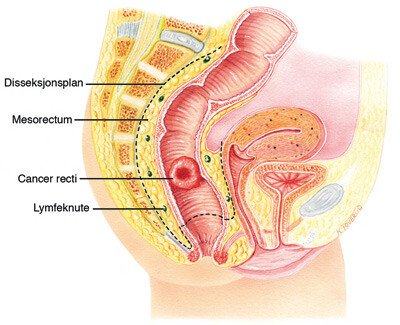
Disse svulstene infiltrerer gjennom submucosa og inn i muscularis propria i ytre del av tarmveggen. For gruppen som helhet er det 27 % av T2-svulstene som har metastaser til lymfeknuter, dvs. TNM-stadium 3 (8). Med bakgrunn i dette er standard behandling av T2-svulster stor reseksjon i form av lav fremre reseksjon, rectumamputasjon eller Hartmanns prosedyre med total mesorektal eksisjon, noe som sikrer fjerning av hele primærsvulsten og den lymfatiske spredningsveien fra tumor (fig 3).
Tumorvekst gjennom tarmveggen (T3-svulster)
T3-svulstene vokser gjennom tarmveggen og ut i det perirektale fettvevet (mesorectum) (tabell 1). Det kan være mindre T3-svulster som så vidt har vokst ut i fettevet, eller svære svulster som vokser helt ut mot den mesorektale fascien i større eller mindre områder. Den norske populasjonsbaserte studien ved Eriksen og medarbeidere viser at det er betydelig forskjell i prognose mellom ulike grupper av T3-svulster (20). Avstanden mellom ytre del av primærtumor og den mesorektale fascien (circumferential resection margin, CRM) og lymfeknutestatus er de viktigste prognostiske faktorer for T3-svulstene, både hva gjelder risiko for lokalt residiv, metastase og død. For svulster der denne avstanden er målt til 3 mm eller mindre skal det etter de norske retningslinjene nå gis preoperativ radiokjemoterapi. Deretter utføres stor reseksjon med TME-teknikk (fig 3).
Tabell 1
Definisjoner og begreper
| Mesorectum | Krøset til rektum med bl.a. fettvev, blodkar, lymfesystem og nerver |
| Mesorektale fascie | Fascie som omgir mesorektum |
| TEM | Transanal endoskopisk mikrokirurgi; lokal reseksjon via operasjonsrektoskop ved tidlig cancer |
| TME | Total mesorektal eksisjon; større kirurgi for rectumcancer som vist i figur 3 |
| Reseksjonsstatus etter behandling, R-stadium (International Union Against Cancer, 1997) | R0 = Ingen resttumor R1 = Mikroskopisk resttumor R2 = Makroskopisk resttumor |
Lokalavanserte svulster (T4)
Disse svulstene vokser ut gjennom mesorectum og inn i et annet organ. Dermed vil maligne celler også kunne benytte dette organets spredningsvei, dvs. andre lymfebaner enn primært gjennom mesorectum. For å øke sjansen for helbredelse av pasienter med svulster i dette stadiet anbefales preoperativ radiokjemoterapi. Deretter gjøres lav fremre reseksjon, rectumamputasjon eller Hartmanns prosedyre og eventuelt ekstirpasjon av de organer som er infiltrert av cancer. Dette forutsetter at pasientens allmenntilstand er tilfredsstillende med hensyn til å tåle inngrepet.
Såkalt bekkeneksenterasjon (fjerning av bekkenorganene) utføres hos pasienter med lokalavansert sykdom uten tegn til metastaser. I andre tilfeller kan det gjøres palliativ tumorreduserende kirurgi, avlastende stomi eller innleggelse av en stent for å holde tarmrøret åpent. Hvilken strategi som velges, vil avhenge av utbredelsen av canceren, lokalt eller perifert, og pasientens tilstand.
Det er reseksjonsstatus (R-stadium) (ramme 1) som avgjør prognosen ved T4-svulstene. Ved komplett makroskopisk og mikroskopisk frie reseksjonsrender (R0) foreligger en rundt 50 % femårsoverlevelse, mens den ved R1 er ca. 20 % og ved R2 ca. 10 % (21).
Lymfeknutestatus
Nær 70 % av pasientene som behandles med kurativ intensjon har ikke malign infiltrasjon av lokale eller regionale lymfeknuter (N0) (22). Dette innebærer at sykdommen er i et tidlig stadium, TNM 1 – 2. Malign infiltrasjon av lymfeknuter (N1 – 2) dobler risikoen for lokalt residiv, metastaser og død (5, 21) – (23). Hittil er det likevel ingen studier som har vist overlevelsesgevinst ved å bruke postoperativ kjemoterapi ved spredning til lymfeknuter ved cancer i rectum, i motsetning til situasjonen ved cancer i colon. Dette støtter bruken av total mesorektal eksisjon, dvs. at det er avgjørende for prognosen å fjerne hele spredningsveien for primærsvulsten.
Alder og prognose
Unge pasienter
I Norge er omkring 5 % av pasientene med rectumcancer yngre enn 50 år på diagnosetidspunktet. Flere studier har vist at yngre pasienter har en dårlig prognose (22) – (24).
I en av studiene fra det norske rectumcancerprosjektet ble det vist at pasienter under 40 år har betydelig dårligere prognose enn pasienter i alderen 40 – 70 år. Dette er relatert til mer aggressive histopatologiske karakteristika og et mer avansert sykdomsstadium på diagnosetidspunktet. Også etter kurativ kirurgi er frekvensen av metastaser signifikant høyere og femårsoverlevelsen signifikant lavere for pasienter under 40 år. Multivariate analyser viser at alder under 40 år er en signifikant og uavhengig negativ prognostisk faktor, hvilket kan indikere en annen tumorbiologi eller dårligere forsvar mot malign cellevekst hos de yngste pasientene.
Eldre pasienter
De fleste pasienter med rectumcancer er eldre, og i Norge er gjennomsnittsalderen for denne pasientgruppen omtrent 70 år (25). På grunn av høyere komorbiditet hos eldre avtar frekvensen av pasienter som blir operert for rectumcancer med alderen. I Norge blir 77 % av rectumcancerpasientene med median alder 70 år operert med kurativ reseksjon, mens det bare er 47 % av pasienter over 85 år som gjennomgår kurativ kirurgi (26) – (28). Ved stor, radikal kirurgi hos pasienter over 80 år er den postoperative mortalitet 7 – 8 %, sammenliknet med 3 % for pasienter i alderen 65 – 79 år. Frekvensen av lokalt residiv, metastaser og relativ overlevelse påvirkes ikke av høy alder.
Residivfrekvens og prognose
Gjennomsnittlig frekvens av lokalt residiv ble halvert i løpet av de første seks årene av det norske prosjektet, fra 18 % i 1993 – 94 til 9 % i 1999 (25, 29, 30). Det var betydelige variasjoner i resultater mellom sykehus, fra under 5 % lokalt residiv ved noen avdelinger, til over 30 % ved andre (30). Ulike tiltak overfor avdelinger med dårlige resultater har gjort at disse har klart å bedre kvaliteten på sin behandling (30).
Risikoen for metastasering for radikalopererte pasienter i TNM-stadium 1 – 3 var ca. 24 %, og fem års totaloverlevelse for pasienter under 75 år var 71 % (25).
Komplikasjoner
Anastomosesvikt er den mest fryktede komplikasjonen ved lav fremre reseksjon. For perioden 1993 – 99 var det 11 % anastomosesvikt blant mer enn 2 000 lave fremre reseksjoner ved norske sykehus (15). Samtidig var det en klar reduksjon av anastomosesvikt i løpet av perioden, fra 17 % i 1993 – 94 til 8 % i 1999. Det anbefales avlastende ileostomi ved lave anastomoser (≤ 6 cm) og etter preoperativ strålebehandling.
Postoperativ mortalitet (innen 30 dager) varierte fra 2,5 % ved de største sykehusene til 3,9 % ved de minste sykehusene i Norge (15). Rectumcancerprosjektet viste at de gruppene av sykehus som hadde høyest frekvens av lokalt residiv også hadde mest anastomosesvikt og høyest postoperativ mortalitet (15).
Diskusjon
Utviklingen av kirurgi for rectumcancer peker i retning av stadig mer skreddersydd behandling, best mulig tilpasset den enkelte pasient sett i forhold til svulstens stadium. Den preoperative kartleggingen blir stadig mer detaljert. Det anbefales nå at et team av dedikerte eksperter innen kolorektal kirurgi, radiologi, patologi og onkologi møtes for å diskutere strategi for hver enkelt pasients behandling. Det er slutt på den tiden da enhver kirurg under utdanningstiden alene ble tillatt å håndtere pasienter med rectumcancer. Vi anbefaler at kirurger under utdanningen i kolorektal kirurgi læres opp gradvis og er under nøye oppsikt og veiledning ved operasjon av rectumcancer, dvs. akkreditering. Mer kirurgisk kompetanse på operasjonsstuen, helst tre kirurger for hver prosedyre, og kontinuerlig kvalitetssikring av hele behandlingen er blitt en selvfølgelig del av den kirurgiske hverdagen.
Det norske prosjektet har medført en sentralisering av behandlingen for rectumcancer. Sannsynligvis har det også påvirket funksjonsfordelingen av annen kreftkirurgi, da resultatene fra prosjektet trolig kan ha overføringsverdi til annen avansert medisin.
Oppgitte interessekonflikter: Ingen
Tabell
| Hovedbudskap |
|
- 1.
Heald RL, Husband EM, Ryall RD. The mesorectum in rectal cancer surgery – the clue to pelvic recurrence? Br J Surg 1982; 69: 613 – 6.
- 2.
Dahl O, Horn A, Morild I et al. Low-dose preoperative radiation postpones recurrence in operable rectal cancer. Cancer 1990; 66: 2286 – 94.
- 3.
Rein KA, Wiig JN, Sæther OD et al. Lokalt residiv ved cancer recti. Tidsskr Nor Lægeforen 1987; 107: 2318 – 20.
- 4.
Bjerkeset T, Edna T-H. Rectal cancer: the influence of type of operation on local recurrence and survival. Eur J Surg 1996; 162: 643 – 8.
- 5.
Wibe A, Moller B, Norstein J et al. A national strategic change in treatment policy for rectal cancer – implementation of total mesorectal excision (TME) as routine treatment in Norway. A national audit. Dis Colon Rectum 2002; 45: 857 – 66.
- 6.
Eriksen MT, Wibe A, Syse A et al. Inadvertent perforation during rectal cancer resection in Norway. Br J Surg 2004; 91: 210 – 6.
- 7.
Endreseth BH, Wibe A, Svinsås M et al. Postoperative morbidity and recurrence after local excision of rectal adenomas and rectal cancer by transanal endoscopic microsurgery. Colorectal Dis 2005; 7: 133 – 7.
- 8.
Endreseth BH, Myrvold HE, Romundstad P et al. Transanal excision versus major surgery for T1 rectal cancer. Dis Colon Rectum 2005; 48: 1380 – 8.
- 9.
Lezoche E, Guerrieri M, Paganini AM et al. Long-term results of patients with pT2 rectal cancer treated with radiotherapy and transanal endoscopic microsurgical excision. World J Surg 2002; 26: 1170 – 4.
- 10.
Sowden AJ, Grilli R, Rice N. The relationship between hospital volume and quality of health outcomes. I: Ferguson B, Posnett JW, Sheldon TA, red. Concentration and choice in the provision of hospital services. York: NHS Centre for Reviews and Dissemination, University of York, 1997.
- 11.
Place M. The relationship between concentration, patient accessibility and utilization of services. I: Ferguson B, Posnett JW, Sheldon TA, red. Concentration and choice in the provision of hospital services. York: NHS Centre for Reviews and Dissemination, University of York, 1997.
- 12.
Hewitt M, Petitti D, red. Interpreting the volume-outcome relationship in the context of cancer care. Washington, DC: The National Academies Press, 2001.
- 13.
Hewitt M. Interpreting the volume-outcome relationship in the context of health care quality. Report from the Institute of Medicine, Washington, DC, 2000. www.nap.edu (17.4.2007).
- 14.
The Norwegian Centre for Health Technology Assessment. SMM Report 2001; nr. 2. www.sintef.no/smm (17.4.2007).
- 15.
Wibe A, Eriksen MT, Syse A et al. Effect of hospital caseload on long-term outcome after standardization of rectal cancer surgery at a national level. Br J Surg 2005; 92: 217 – 24.
- 16.
Porter GA, Soskolne CL, Yakimetz WW et al Surgeon-related factors and outcome in rectal cancer. Ann Surg 1998; 227: 157 – 67.
- 17.
Nivatvongs S. Surgical management of early colorectal cancer. World J Surg 2000; 24: 1052 – 5.
- 18.
Kikuchi R, Takano M, Takagi K et al. Management of early invasive colorectal cancer. Dis Colon Rectum 1995; 38: 1286 – 95.
- 19.
Norwegian Gastrointestinal Cancer Group. www.ngicg.no (17.4.2007).
- 20.
Eriksen MT, Wibe A, Haffner J et al. Prognostic groups in 1,676 patients with T3 rectal cancer treated without preoperative radiotherapy. Dis Colon Rectum 2007; 50: 156 – 67.
- 21.
Eriksen MT, Wibe A, Hestvik UEJ et al. Surgical treatment of primary locally advanced rectal cancer in Norway. Eur J Surg Oncol 2006; 32: 174 – 80.
- 22.
Wibe A, Syse A, Andersen E et al. Oncological outcomes after total mesorectal excision for cure for cancer of the lower rectum: anterior vs. abdominoperineal resection. Dis Colon Rectum 2004; 47: 48 – 58.
- 23.
Wibe A, Rendedal PR, Svensson E et al. Prognostic significance of the circumferential resection margin following total mesorectal excision for rectal cancer. Br J Surg 2002; 89: 327 – 34.
- 24.
Endreseth BH, Romundstad P, Myrvold HE et al. Rectal cancer in the young patient. Dis Colon Rectum 2006; 49: 993 – 1001.
- 25.
O’Connell JB, Maggard MA, Livingston EH et al. Colorectal cancer in the young. Am J Surg 2004; 187: 343 – 8.
- 26.
O’Connell JB, Maggard MA, Liu JH et al. Rates of colon and rectal cancers are increasing in young adults. Am J Surg 2003; 69: 866 – 72.
- 27.
Wibe A, Eriksen MT, Syse A et al. Total mesorectal excision for rectal cancer--what can be achieved by a national audit? Colorectal Dis 2003; 5: 471 – 7.
- 28.
Endreseth BH, Romundstad P, Myrvold HE et al. Rectal cancer treatment of the elderly. Colorectal Dis 2006; 8: 471 – 9.
- 29.
Wibe A. Rectal cancer treatment in Norway – Standardisation of surgery and quality assurance. Trondheim: Norges teknisk-naturvitenskapelige universitet, 2003.
- 30.
Wibe A, Carlsen E, Dahl O et al. Nationwide quality assurance of rectal cancer treatment. Colorectal Dis 2006; 8: 224 – 9.