Background.
The mortality of cardiovascular disease has decreased substantially in later years though it is uncertain whether this decrease is due to a better profile of risk factors in the population or to improvements in medical treatment.
Material and methods.
In 1982 to 1984 and 1997 to 1999 all patients admitted to Hedmark Central Hospital in Norway, with acute myocardial infarction were registered and followed for reinfarction and survival over up to three years. A total of 1,236 patients were included in the study, 641 in the first time period and 595 in the second.
Results.
A significant decrease in case fatality was observed in the second population. The seven days fatality rate decreased from 17.9 % to 11.4 %, and the one month fatality rate from 22.9 % to 16.1 %. The median number of days in hospital decreased from ten to six. A Kaplan-Meier estimate for survival in the total follow-up period showed a 43 % higher relative death risk in the 1982 – 1984 cohort compared to the 1997 – 1999 cohort. A Cox regression revealed that this difference could not be explained by demographic differences between the populations.
Interpretation.
By evaluating variables registered during the course of infarction in the multivariate Cox model, it is concluded that improved survival in the recent cohort is related to modern treatment of acute myocardial infarction.
Behandling av pasienter med akutt hjerteinfarkt har gjennomgått en betydelig utvikling i de siste 20 årene. I samme tidsrom har dødeligheten av hjerte- og karsykdommer avtatt (1). En rekke nye behandlingsstrategier har vist seg å bedre prognosen for pasienter med koronarsykdom (2 – 11). Det har imidlertid vært uklart om den observerte nedgangen i dødelighet kan forklares ut fra en bedret risikoprofil generelt i befolkningen eller et bedret behandlingstilbud. Det har også vært vanskelig å vise en stor gevinst i kliniske studier av sykehusmortalitet etter infarkt, og i Norge er det i tillegg sparsomt med slike studier (1, 12, 13). Videre har dødeligheten i epidemiologiske studier ligget på et høyere nivå enn det som er funnet i kontrollerte kliniske forsøk.
Ved Sentralsjukehuset i Hedmark, Hamar, ble det i årene 1982 – 84 gjort en registrering av alle pasienter innlagt med diagnosen hjerteinfarkt. Disse ble fulgt med hensyn til overlevelse via Statistisk sentralbyrås dødsregister til 1.1. 1985. Resultatene derfra er tidligere publisert i forskjellige artikler (14 – 19). I årene 1997 – 99 ble det gjort en tilsvarende registrering av alle pasienter innlagt i sykehuset med akutt hjerteinfarkt. Disse er fulgt på samme måte med hensyn til overlevelse til 1.1. 2000, og man har registrert de samme kliniske parametere. En sammenlikning av dødeligheten i disse populasjonene skulle derfor være egnet til å vurdere i hvilken grad nye behandlingsprinsipper har påvirket overlevelsen i en uselektert gruppe av sykehuspasienter med akutt hjerteinfarkt.
Materiale og metode
I to treårsperioder (1.1. 1982 – 31.12. 1984 og 1.1. 1997 – 31.12. 1999) ble alle pasienter innlagt i Sentralsjukehuset i Hedmark, Hamar, med akutt hjerteinfarkt registrert, men bare pasienter bosatt i sykehusets opptaksområde inngikk i den videre analysen. Denne begrensningen ble gjennomført for å kunne få mer pålitelig informasjon om det videre forløpet av infarktet, hyppigheten av reinfarkt og videre utredning. Pasientene ble identifisert fra sykehusets datasystem via de diagnosekodene for akutt hjerteinfarkt som fantes på de forskjellige tidspunktene, og overlevelse identifisert via det sentrale personregister per 1.1. 1985 for den første populasjonen og 1.1. 2000 for den andre. Tillatelse til denne registrering ble gitt av Statens helsetilsyn og Datatilsynet.
Diagnosen hjerteinfarkt ble revurdert ved gjennomgang av journalene og basert på tilstedeværelsen av to av tre kriterier:
– Sentrale brystsmerter av minst 15 minutters varighet.
– Minst én verdi av enzymatisk diagnostikk (ASAT, uten ALAT-stigning i 1982 – 84, CKMB (kreatinkinase MB fraksjon) - stigning i populasjonen fra 1997 – 99) over øvre referansegrense.
– Nye Q-takker eller tap av R-takker eller dynamiske ST-T-forandringer i EKG.
Infarktlokalisasjon ble bestemt ut fra EKG. Kriteriene for infarktlokalisasjon var basert på dem som ble anvendt i MIAMI-studien (20). Resiproke forandringer ble definert som ST-segmentdepresjoner i avledninger som ikke omfattet infarktet. Et tidligere infarkt ble identifisert ut fra sykehistorie og/eller tilstedeværelse av gamle infarktforandringer på innleggelses-EKG. Primær ventrikkelflimmer ble definert som ventrikkelflimmer i fravær av kardiogent sjokk og betydelig hjertesvikt. Ventrikkeltakykardi ble registrert om den var symptomatisk og/eller vedvarende (> 15 sekunder). Pulsfrekvens før utreise ble registrert i hvile om morgenen på siste sykehusdag (hos pasienter som døde under sykehusoppholdet er den siste morgenregistreringen brukt). Diagnosen diabetes mellitus ble akseptert dersom den var etablert før innleggelse eller førte til behandling under innleggelse (medikamenter eller kostbehandling). Preinfarktangina ble definert som en forverring av en stabil angina eller nyoppstått angina i siste uke før infarktet og av varighet minst et døgn før infarktdebut. Røyking ble definert som daglig tobakksforbruk inntil tidspunkt for indeksinfarktet eller start av preinfarktangina. Serum-natrium, -kalium og -kreatinin er de verdier som ble målt ved første blodprøve etter innleggelse. LD (laktatdehydrogenase) var eneste enzymmarkør for myokardskade som ble målt i begge populasjonene. All medikamentell behandling av kardiovaskulær sykdom ble registrert ved innleggelse og utskrivning. Reinfarkt i observasjonsperioden ble dokumentert fra journalene, som alle ble gjennomgått etter henholdsvis 1.1. 1985 og 1.1. 2000.
Statistisk analyse
De kontinuerlige variablene ble undersøkt med hensyn til normalfordeling med Liliefors’ versjon av Kolmogorov-Smirnovs test. Forskjeller mellom de to populasjonene ble bedømt med Kruskal-Wallis’ test for kontinuerlige variabler og khikvadrattest med Yates kontinuitetskorreksjon eller Fishers eksakte test for kategoriske variabler. Univariat analyse av overlevelse ble undersøkt med Kaplan-Meier-estimering og logranktest. Cox’ regresjonsmodell ble brukt for multivariat estimering av overlevelse. Logistisk regresjon ble brukt for å bedømme samvariasjon mellom dikotome og kontinuerlige variabler. Den statistiske analysen er utført i Systat (SPSS Inc).
Resultater
Det ble i 1982 – 84 registrert 641 og i 1997 – 99 595 pasienter som fylte de ovenfornevnte kriteriene. Materialet utgjør derfor til sammen 1 236 pasienter som er fulgt i opptil tre år med hensyn til reinfarkt og død.
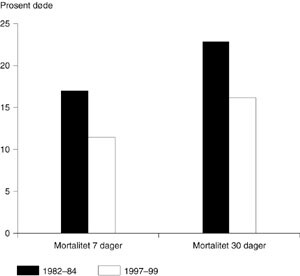
Figur 1 viser mortalitet etter sju dager (17,9 % mot 11,4 %) og en måned (22,9 % mot 16,1 %). Dødeligheten etter sju og 30 dager var redusert med henholdsvis 36,3 % og 29,7 %. Sykehusdødeligheten sank fra 22,3 % til 13,6 %. Forskjellene var signifikante for alle sammenlikninger (p< 0,01).
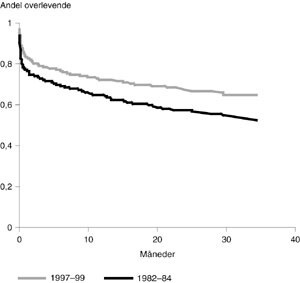
Forskjellen i overlevelse i hele observasjonsperioden på inntil tre år er vist i figur 2. Den relative risiko for død i materialet fra 1982 – 84 i forhold til perioden 1997 – 99 var 1,43 (95 % konfidensintervall 1,18 – 1,73). Kliniske karakteristika på tidspunktet for innleggelse er angitt i tabell 1. Alle de kontinuerlige variabler avvek signifikant fra normalfordelingen. Det er derfor systematisk brukt ikke-parametriske tester for kontinuerlige variabler i undersøkelse av forskjeller mellom populasjonene. Tabell 1 viser statistisk signifikante forskjeller i de fleste variablene, men forskjellene er relativt små. Når det gjelder serum-natrium og serum-kreatininnivå er det overveiende sannsynlig at de forskjeller som påvises, skyldes endring av analysemetoder i laboratoriet, hvilket det er korrigert for i den videre analysen.
Tabell 1
Kliniske karakteristika ved innleggelsen. Kontinuerlige variabler er angitt i gjennomsnitt ± standardavvik med median verdi i parentes, kategoriske variabler i prosent. Forskjeller mellom de to populasjonene er undersøkt med Kruskal-Wallis’ og Fishers eksakte test for henholdsvis kontinuerlige og kategoriske variabler
| 1982 – 84 |
1997 – 99 |
P-verdi |
|
| Alder |
67,6 ± 10,8 (68) |
70,2 ± 12,8 (73) |
< 0,001 |
| Menn/kvinner (%) |
68,0/32,0 |
62,5/37,5 |
0,05 |
| Tidligere infarkt (%) |
24,3 |
30,9 |
0,01 |
| Diabetes mellitus (%) |
14,8 |
15,3 |
0,81 |
| Insulinbehandlet diabetes (%) |
3,7 |
7,9 |
< 0,01 |
| Preinfarktangina (%) |
38,5 |
44,7 |
0,03 |
| Røykere (%) |
47,7 |
53,3 |
< 0,001 |
| Serum-natrium (mmol/l) |
138,6 ± 3,6 (139) |
139,4 ± 3,0 (140) |
< 0,001 |
| Serum-kalium (mmol/l) |
4,1 ± 0,6 (4,1) |
4,2 ± 0,5 (4,2) |
0,58 |
| Serum-kreatinin ( µ mol/l) |
128,1 ± 64,9 (109) |
97,1 ± 47,3 (86) |
< 0,001 |
Tabell 2 angir EKG-forandringene i de to materialene. Man kan se at det er signifikant færre Q-infarkter i materialet fra 1990-årene. Lokalisasjon og forekomst av resiproke forandringer var uendret mellom de to materialene.
Tabell 2
EKG-forandringer. Forskjeller mellom de to populasjonene er undersøkt med Fishers eksakte test
| 1982 – 84 |
1997 – 99 |
P-verdi |
|
| Q-infarkt (%) |
54,4 |
45,5 |
< 0,01 |
| Q-infarkt hos pasienter uten trombolytisk behandling (%) |
54,4¹ |
33,0 |
< 0,001 |
| Fremreveggsinfarkt (%) |
42,1 |
41,4 |
0,82 |
| Nedreveggsinfarkt (%) |
28,6 |
30,0 |
0,62 |
| Infarkt ikke lokaliserbart (%) |
29,3 |
28,6 |
0,85 |
| Resiproke forandringer (%) |
26,7 |
27,2 |
0,85 |
| |||
De kliniske variablene som er registrert under forløpet er angitt i tabell 3. Antall liggedager i sykehuset, pulsfrekvens ved utskrivning og maksimal LD-verdi under infarktet var redusert, men det var ingen forskjell i forekomst av reinfarkter.
Tabell 3
Kliniske variabler registrert under forløpet av og oppfølgingen etter infarktet. Kontinuerlige variabler er angitt i gjennomsnitt ± standardavvik med median verdi i parentes, kategoriske variabler i prosent. Forskjeller mellom de to populasjonene er undersøkt med Kruskal-Wallis’ test for kontinuerlige variabler og khikvadrattest eller Fishers eksakte test for kategoriske variabler. Forskjellen i reinfarkt under oppfølging er undersøkt med logranktest for å kunne ta hensyn til tid for reinfarkt
| 1982 – 84 |
1997 – 99 |
P-verdi |
|
| Antall sykehusdager |
11,1 ± 7,2 (10) |
7,8 ± 5,0 (6) |
< 0,001 |
| Atrieflimmer – ny (%) |
13,1 |
13,7 |
|
| Atrieflimmer – kronisk (%) |
7,8 |
7,1 |
0,89¹ |
| Primær ventrikkelflimmer (%) |
3,1 |
4,8 |
0,14 |
| Ventrikkeltakykardi (%) |
5,5 |
7,5 |
0,16 |
| Pulsfrekvens ved utskrivning |
73,2 ± 15,7 (70) |
67,8 ± 15,1 (66) |
< 0,001 |
| Maksimal LD-verdi (U/l) |
1361 ± 1167 (1072) |
1138 ± 942 (844) |
< 0,001 |
| Reinfarkt i oppfølgingstiden (%) |
11,9 |
13,4 |
0,23 |
| 1 Atrieflimmer: ingen/ny/kronisk er evaluert samlet med khikvadrattest | |||
Tabell 4 angir medikamentell behandling ved innleggelse og utskrivning med medikamenter som også fantes i 1980-årene.
Tabell 4
Medikamentbruk ved innleggelse og utskrivning. Forskjeller i hyppighet av bruk av medikamenter mellom de to populasjonene er evaluert ved Fishers eksakte test
| 1982 – 84 |
1997 – 99 |
P-verdi |
|
| Innleggelse |
|||
| Betablokker (%) |
23,1 |
26,2 |
0,21 |
| Kalsiumantagonist (%) |
6,5 |
13,2 |
< 0,001 |
| Digitalis (%) |
25,6 |
6,8 |
< 0,001 |
| Diuretika (%) |
26,8 |
19,0 |
0,001 |
| Langtidsvirkende nitroglyserin (%) |
11,2 |
24,5 |
< 0,001 |
| Utskrivning |
|||
| Betablokker (%) |
44,3 |
75,6 |
< 0,001 |
| Kalsiumantagonist (%) |
11,5 |
10,1 |
0,46 |
| Digitalis (%) |
34,9 |
11,6 |
< 0,001 |
| Diuretika (%) |
46,5 |
42,7 |
0,19 |
| Langtidsvirkende nitroglyserin (%) |
21,7 |
32,7 |
< 0,001 |
Opplysninger som var tilgjengelig ved innleggelsestidspunktet (tab 1, tab 4) ble brukt for å lage en multivariat Cox-modell for overlevelse for begge periodene. Serum-kreatinin ble inkludert i modellen etter transformasjon til den naturlige logaritme, og serum-natrium ble inkludert som en dikotom variabel (lav/ikke lav) delt ved 25-percentilen (137 mmol/l). Den endelige modell er vist i tabell 5. Det ble ikke påvist effektmodifikasjon eller interaksjoner i modellen. Den relative risiko for død i det tidligere materialet (1,60, 95 % konfidensintervall 1,29 – 1,97) er ikke blitt redusert etter justering for demografiske variabler og andre variabler vurderbare ved innleggelsen.
Tabell 5
Cox-modell for multivariat bedømmelse av langtidsoverlevelse med variabler tilgjengelig ved innleggelsen
| Variabel |
Relativ risiko |
95 % konfidensintervall |
P-verdi |
| Alder /5 år |
1,26 |
1,20 – 1,33 |
< 0,001 |
| Infarkt 1982 – 84/1997 – 99 |
1,60 |
1,29 – 1,97 |
< 0,001 |
| Serum-natrium lav/ikke lav |
1,60 |
1,28 – 2,00 |
< 0,001 |
| Bruk av digitalis ved innleggelse |
1,30 |
1,03 – 1,63 |
0,03 |
| Serum-kreatinin (ln µ mol/l) |
2,67 |
2,13 – 3,34 |
< 0,001 |
Det var ingen forskjell i forekomst av reinfarkter i de to observasjonsperiodene bedømt ved logranktest (tab 3), og om man testet Cox-modellen hos pasienter uten reinfarkt, var den relative risiko uendret (1,70, 95 % konfidensintervall 1,35 – 2,15).
I materialet fra 1997 – 99 ble det brukt andre (og mer nøyaktige) enzymmarkører for infarkt (CKMB). Det ble derfor utført en separat analyse med modellen der man utelot pasienter med CKMB-verdier mindre enn medianverdien i materialet fra 1997 – 99. Dette medførte imidlertid ingen endring i relativ risiko, som fortsatt var 1,73 (95 % konfidensintervall 1,31 – 2,28).
I den endelige Cox-modellen er deretter variabler fra infarktforløpet (tab 2 – 4) i begge perioder undersøkt med henblikk på om de kan modifisere den økte risiko for død i materialet fra 1980-årene. Hyppighet av Q-infarkter påvirket ikke den relative risiko mellom populasjonene. Ved å legge maksimal LD-verdi inn i modellen fås en moderat reduksjon i den relative risiko til 1,44, men fortsatt en signifikant overdødelighet i populasjonen fra 1982 – 84.
Pulsfrekvens og bruk av betablokker ved utskrivning var begge korrelert til dødelighet. Om variablene hver for seg ble lagt til i den basale Cox-modellen, ble den relative risiko for den tidligste infarktpopulasjonen 1,20 (95 % konfidensintervall 0,96 – 1,50) etter inklusjon av pulsfrekvens og 1,11 (95 % konfidensintervall 0,88 – 1,39) etter inklusjon av betablokker ved utskrivning. Dersom både pulsfrekvens og bruk av betablokker ved utskrivning legges til, er den relative risiko mellom populasjonene 1,05 (0,83 – 1,34). Om man også legger maksimal LD-verdi inn i modellen, er den relative risiko 0,91 (0,71 – 1,16).
Det er en betydelig og signifikant samvariasjon mellom pulsfrekvens og bruk av betablokker ved utskrivning. De er også begge signifikant korrelert til mange andre risikofaktorer for død, som alder, kreatininverdi og medikamentell behandling. Pulsfrekvens ved utskrivning var imidlertid også høygradig korrelert til mortalitet også i den subgruppen som verken brukte betablokker ved innleggelse eller ved utskrivning. Det var videre en signifikant korrelasjon mellom senere invasiv utredning og både pulsfrekvens og bruk av betablokker ved utskrivning (p< 0,001 for begge).
Av pasientene fra 1997 – 99 fikk 28,1 % trombolytisk behandling. Ved innleggelse brukte 16,5 % ACE-hemmere, 21,4 % brukte acetylsalisylsyre og 10,1 % statiner. Ved utskrivningen brukte 38,0 % ACE-hemmere, 68,4 % acetylsalisylsyre, 17,7 % warfarin, 42,8 % statiner, og 28,0 % ble henvist til invasiv utredning. I gruppen som ble behandlet i 1997 – 99, var det en overveldende majoritet (95,1 %) som fikk en eller annen medikamentell behandling som ikke var tilgjengelig/ikke i bruk i 1980-årene.
Diskusjon
Materialet består av pasienter fra samme geografiske område innlagt i samme sykehus for et akutt hjerteinfarkt i to treårsperioder med 15 års mellomrom. Dødeligheten etter et infarkt har i dette tidsrommet falt kraftig (fig 1). Samtidig har man fått en betydelig reduksjon i antall liggedøgn i sykehus (tab 3).
Den estimerte risiko for død i oppfølgingstiden på inntil tre år viser en reduksjon på nær 38 % (fig 2).
Den påviste bedrede overlevelse kunne ikke forklares ved endringer i demografiske data. Den ujusterte relative risiko for død i populasjonen fra 1982 – 84 var 1,43 (fig 2), og den relative risiko ble større når demografiske variabler ble inkludert i modellen (tab 5).
Man fant ingen reduksjon i antall reinfarkter (tab 3), og bedret overlevelse i populasjonen fra 1997 – 99 kunne påvises allerede i løpet av det første døgnet hos pasienter med førstegangsinfarkt (3,2 % mot 6,6 %, p = 0,02). Den relative risiko mellom populasjonene var også uavhengig av forekomst av reinfarkt. Således kan ikke hyppighet eller alvorlighetsgrad av reinfarkt forklare forskjellen i dødelighet.
Når man i Cox-modellen inkluderer variabler observert under forløpet av infarktet, ser man at den påviste reduksjon i hyppigheten av Q-infarkter ikke kunne forklare den bedrede overlevelsen. Maksimal LD-verdi, som kan tas som et grovt uttrykk for infarktstørrelse (21, 22), medførte en liten reduksjon i relativ risiko, fra 1,60 til 1,44. Dette kan tas til inntekt for at en del av effekten på overlevelse er at infarktstørrelsen er noe mindre i materialet fra 1990-årene, noe som også er vist i andre studier (23).
Pulsfrekvens og bruk av betablokker ved utskrivning reduserte forskjellen i risiko mellom populasjonene så mye at den ikke lenger var statistisk signifikant når de ble inkludert i Cox-modellen. Pulsfrekvens ved utskrivning er korrelert til venstre ventrikkels funksjon (24), og effekten kan forklares ved at venstre ventrikkel er mindre affisert etter infarktet hos pasienter fra 1997 – 99. Om både maksimal LD-verdi og pulsfrekvens legges til Cox-modellen, faller den relative risiko til 1,14 (95 % konfidensintervall 0,91 – 1,43). Dette kan bety at selv om begge variablene sier noe om venstre ventrikkels funksjon etter infarktet, rommer de hver for seg noe forskjellig informasjon.
Når det gjelder den gunstige effekten ved bruk av betablokker ved utskrivning, er trolig tolkingen komplisert. Bruk av betablokker var i begge populasjonene sterkt korrelert til andre faktorer som predikerer god prognose, som lavere alder, lavere serum-kreatininverdi og lavere pulsfrekvens både ved innleggelse og utskrivning. I tillegg var det sterk samvariasjon mellom bruk av betablokker og andre nyere behandlinger i populasjonen fra 1990-årene (trombolytisk behandling, bruk av acetylsalisylsyre, statiner, ACE-hemmere). Bruken av betablokker ved utskrivning identifiserer derfor en gruppe pasienter som ut fra demografiske og kliniske kriterier kan sies å ha en relativt god prognose. I tillegg er dette en gruppe pasienter som i stor grad er blitt behandlet ut fra moderne behandlingsprinsipper som ikke fantes i 1982 – 84. Variabelen brukt i denne sammenheng inneholder derfor informasjon om flere forhold og er ikke bare et mål på hvor viktig det er å bruke betablokker etter et infarkt, selv om den effekten også spiller inn.
Mange studier har vist fallende dødelighet etter hjerteinfarkt i de senere år (12, 13, 24 – 31). Det har imidlertid vært vanskelig å vise om denne utviklingen skyldes bedrede behandlingstilbud, med nedgang i letalitet og færre reinfarkter, eller nedgang i risikofaktorer i befolkningen (13). I dette materialet kan man påvise en klar og betydelig nedgang i letaliteten etter et akutt infarkt. Denne nedgangen kunne ikke forklares ved demografiske endringer, nedgang i reinfarkter eller definisjonsendringer for infarkt.
Nesten alle pasienter i 1997 – 99 fikk en eller annen form for medikamentell behandling som ikke var i bruk i 1982 – 84. De variablene som kunne forklare forskjellen i dødelighet, var relatert til venstre ventrikkels funksjon og bruk av moderne behandlingsmetoder.
Konklusjon
Den estimerte letaliteten hos pasienter fra samme geografiske område innlagt i samme sykehus etter et akutt hjerteinfarkt og fulgt i opptil tre år har sunket med nær 38 % i løpet av 15 år. Dette faller i tid sammen med innføringen av en rekke nye behandlingstilbud for pasienter med akutt infarkt. Undersøkelsen gir sterke holdepunkter for at denne reduksjonen i letalitet er relatert til de nye behandlingstilbudene, og understreker betydningen av moderne infarktbehandling.
Denne undersøkelsen er muliggjort ved et forskningsstipend gitt av Pfizer Norge AS.
- 1.
Mähönen M, Thelle DS. Hvorfor faller dødeligheten av hjerte- og karsykdommer? Tidsskr Nor Lægeforen 2000; 120: 1903 – 5.
- 2.
The Norwegian multicenter study group. Timolol-induced reduction in mortality and reinfarction in patients surviving acute myocardial infarction. N Engl J Med 1981; 304: 801 – 17.
- 3.
ISIS-1 collaborative group. Randomized trial of intravenous atenolol among 16027 cases of suspected myocardial infarction: ISIS – 1. Lancet 1986; 2: 57 – 66.
- 4.
GISSI (Gruppo Italiano per lo Studio della Streptochinasi nell’Infarcto miocardio). Effectiveness of intravenous thrombolytic treatment in myocardial infarction. Lancet 1986; 1: 398 – 402.
- 5.
ISIS-2 (Second International Study of Infarct Survival) Collaborative Group. Randomized trial of intravenous streptokinase, oral aspirin, both, or neither among 17187 cases of suspected acute myocardial infarction: ISIS-2. Lancet 1988; 2: 249 – 60.
- 6.
Wilcox RG, von der Lippe G, Olsson CG, Jensen G, Skene AM, Hampton JR. Trial of tissue plasminogen activator for mortality reduction in acute myocardial infarction: Anglo-Scandinavian Study of Early Thrombolysis (ASSET). Lancet 1988; 2: 525 – 30.
- 7.
The GUSTO Investigators. An international randomized trial comparing four thrombolytic strategies for acute myocardial infarction. N Engl J Med 1993; 329: 673 – 82.
- 8.
Fibrinolytic Trialists’ Collaborative Group. Indications for fibrinolytic therapy in suspected acute myocardial infarction: collaborative overview of early mortality and major morbidity results from all randomized trials of more than 100 000 patients. Lancet 1994; 343: 311 – 22.
- 9.
Scandinavian Simvastatin Survival Study Group. Randomized trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4 S). Lancet 1994; 344: 1383 – 9.
- 10.
ACE Inhibitor Myocardial Infarction Collaborative Group. Indications for ACE inhibitors in the early treatment of acute myocardial infarction: systematic overview of individual data from 100 000 patients in randomized trials. Circulation 1998; 97: 2202 – 12.
- 11.
The Heart Outcomes Prevention Evaluation Study Investigators. Effects of an angiotensin-converting-enzyme inhibitor, ramipril, on cardiovascular events in high-risk patients. N Engl J Med 2000; 342: 145 – 53.
- 12.
Reikvam Å. Forbedret behandling av hjerteinfarkt – hvordan har sykehusdødeligheten utviklet seg? Tidsskr Nor Lægeforen 1999; 119: 1078 – 9.
- 13.
Reikvam Å, Aursnes I for the European Secondary Prevention Study Group. Hospital mortality from acute myocardial infarction has been modestly reduced after introduction of thrombolytics and aspirin: results from a new analytical approach. J Clin Epidemiol 1999; 52: 609 – 13.
- 14.
Mølstad P, Nustad M. Acute myocardial infarction in diabetic patients. Acta Med Scand 1987; 222: 433 – 7.
- 15.
Mølstad P. Prognostisk stratifisering etter hjerteinfarkt. Tidsskr Nor Lægeforen 1988; 108: 1104 – 6.
- 16.
Mølstad P. Primary ventricular fibrillation in acute myocardial infarction. Int J Med 1989; 226: 107 – 11.
- 17.
Mølstad P, Abdelnoor M. Digitoxin associated mortality in acute myocardial infarction. Eur Heart J 1991; 12: 65 – 9.
- 18.
Mølstad P. First myocardial infarction in smokers. Eur Heart J 1991; 12: 753 – 9.
- 19.
Mølstad P. Prognostic significance of type and location of a first myocardial infarction. J Int Med 1993; 233: 393 – 9.
- 20.
The MIAMI trial Research Group. Patients and methods. Am J Cardiol 1985; 56: 3 – 9G.
- 21.
The MIAMI Trial Research Group. Enzymatic estimation of infarct size. Am J Cardiol 1985; 56: 27 – 9G.
- 22.
The Joint European Society of Cardiology/American College of Cardiology Committee. Myocardial infarction redefined – a concensus document of The Joint European Society of Cardiology/American College of Cardiology Committee for the Redefinition of Myocardial Infarction. Eur Heart J 2000; 21: 1502 – 13.
- 23.
Goff DC, Howard G, Wang C-H, Folsom AR, Rosamond WD, Cooper LS et al. Trends in severity of hospitalized myocardial infarction: the Atherosclerosis Risk in Communities (ARIC) Study, 1987 – 1994. Am Heart J 2000; 139: 874 – 80.
- 24.
Hjalmarson Å, Gilpin EA, Kjekshus J, Schieman G, Nicod P, Henning H et al. Influence of heart rate on mortality after acute myocardial infarction. Am J Cardiol 1990; 65: 547 – 53.
- 25.
Marques-Vidal P, Ruidavers J-B, Cambou J-P, Ferrieres J. Incidence, recurrence, and case fatality for myocardial infarction in southwestern France, 1985 to 1993. Heart 2000; 84: 171 – 5.
- 26.
Abrahamson P, Delborg M, Rosengren A, Wilhelmsen L. Improved long term prognosis after myocardial infarction 1984 – 1991. Eur Heart J 1998; 19: 1512 – 7.
- 27.
Tavazzi L. Clinical epidemiology of acute myocardial infarction. Am Heart J 1999; 138: S48 – 54.
- 28.
Capewell S, Livingston BM, MacIntyre K, Chalmers JWT, Boyd J, Finlayson A et al. Trends in case-fatality in 117718 patients admitted with acute myocardial infarction in Scotland. Eur Heart J 2000; 21: 1833 – 40.
- 29.
Stewart AW, Beaglehole R, Jackson R, Bingley W. Trends in three-year survival following acute myocardial infarction, 1983 – 1992. Eur Heart J 1999; 20: 803 – 7.
- 30.
Rogers WJ, Canto JC, Lambrew CT, Tiefenbrunn AJ, Kinkaid B, Shoultz DA et al. Temporal trends in the treatment of over 1.5 million patients with myocardial infarction in the U.S. from 1990 through 1999. J Am Coll Cardiol 2000; 36: 2056 – 63.
- 31.
Goldberg RJ, Yarzebski J, Lessard D, Gore JM. A two-decades (1975 to 1995) long experience in the incidence, in-hospital and long-term case-fatality rates of acute myocardial infarction: a community-wide perspective. J Am Coll Cardiol 1999; 33: 1533 – 9.