Background.
The incidence of type 2 diabetes is increasing. Epidemiological data indicate a need to investigate possible interventions to prevent or delay the onset.
Methods.
Diabetologic and pharmacologic information was retrieved from review papers. Additionally, the Cochrane library and PubMed were searched for relevant studies.
Results.
Recent studies have demonstrated the efficacy of lifestyle intervention and metformin treatment in impaired glucose tolerance. Surgical treatment for obesity could be beneficial for individuals with BMI > 35. Recommendations from the American Diabetes Association for the prevention of type 2 diabetes are opportunistic screening, intervention on lifestyle factors such as physical activity and weight reduction, and also on cardiovascular risk factors.
Interpretation.
«Prediabetes» should be identified and treated by lifestyle intervention in primary health care. National guidelines for primary prevention should also be established.
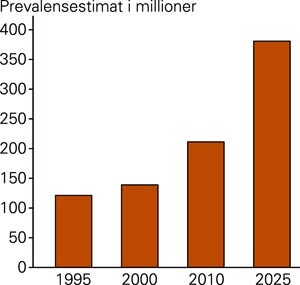
Forekomsten av type 2-diabetes er økende på verdensbasis (1) (fig 1). Norske data viser samme tendens, samtidig er det en økning av overvekt (2).
Type 2-diabetes er knyttet til alvorlige helseproblemer, blant annet utvikles senkomplikasjoner som nyresvikt, retinopati og diabetiske fotsår (3). I tillegg er hjerte- og karsykdom opptil tre ganger så hyppig hos individer med type 2-diabetes (4) som i normalbefolkningen. Dødeligheten av kardiovaskulære sykdommer er 75 % høyere ved type 2-diabetes, med en forkorting av forventet levetid på 5 – 10 år i forhold til ikke-diabetiske individer (5). Kostnadene ved sykdommen er betydelige, for Sverige beregnet til 736 millioner euro i 1998 (6).
Metoder
Denne oversikten baserer seg på kunnskap om diabetes og farmakologi hentet fra oversiktsartikler. Det ble også gjort usystematiske søk i the Cochrane library og PubMed etter studier på området.
Når skal man intervenere?
Tidsmessig er det naturlig å tenke seg en intervensjon når man kan påvise redusert glukosetoleranse, siden risikoen for å utvikle type 2-diabetes senere er høy (7). Redusert glukosetoleranse defineres som plasma-glukose på 7,8 – 11,1 mmol/l to timer etter peroral glukosebelastning (8). Grensestatus (impaired fasting glucose) er et relativt nytt begrep som defineres som fastende plasma-glukose på 6,1 – 7,0 mmol/l, og er ikke nødvendigvis til stede hos individer med forhøyet blodsukkernivå etter peroral glukosebelastning. Sammenhengen mellom grensestatus, diabetesutvikling og senkomplikasjoner er fortsatt uklar.
Dersom det ene eller det andre forholdet er til stede, viser Hoorn-studien at risikoen for å utvikle diabetes innen seks år var 10,0 % ved grensestatus og 10,9 % ved redusert glukosetoleranse (9). Dersom begge faktorer var til stede, var risikoen for å få diabetes innen seks år 39,5 % (9).
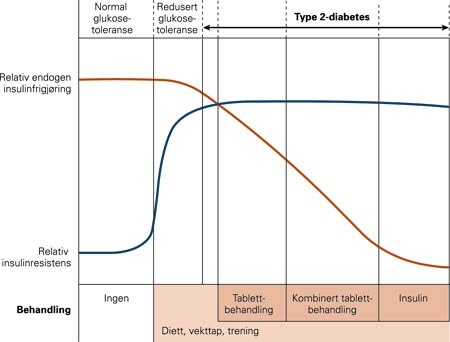
Teoretisk har vi to angrepspunkter for forebygging av type 2-diabetes: insulinresistens og insulinsekresjonssvikt (fig 2) (10).
Ikke-farmakologiske intervensjoner
De fleste har ansett kostholdet som et sentralt intervensjonsområde. Den tydeligste effekten ses ved slanking, der selv et moderat vekttap har vist seg å gi redusert blodsukkernivå og slik påvirke både insulinresistens (11) og sannsynligvis også insulinsekresjon sekundært (11). Det har også vært interesse for intervensjon når det gjelder fettinntaket og utprøvning av effekten av ulike fettyper og fettsyrer, bl.a. har konjugerte linolensyrer vist lovende resultater i dyreforsøk (12). Så langt har tilsvarende studier ikke vist effekt på diabetesforekomsten hos mennesker (13).
Alkohol i moderate mengder (23,0 – 45,9 g) er, sammenliknet med totalavhold eller et høyere daglig forbruk, i epidemiologiske studier assosiert med bedret insulinfølsomhet (14). Røykeslutt kan også bidra til å redusere insulinresistensen (15).
Fysisk aktivitet har lenge vært ansett som et sentralt virkemiddel (16). Det er fortsatt uklart hvilken type aktivitet som er mest effektiv og hvor hyppige og lange treningsintervallene bør være.
En sentral studie i denne sammenheng er The Finnish Diabetes Prevention Study (DPS) (17). Her deltok 522 personer i alderen 40 – 65 år med redusert glukosetoleranse og høy kroppsmasseindeks (BMI, middelverdi 31 kg/m²). Deltakerne i intervensjonsgruppen fikk individuell rådgivning med målsetting å redusere vekten med 5 %, fettinntaket til 30 % og inntaket av mettet fett til 10 % av daglig næringsinntak. I tillegg skulle de ha 30 minutter moderat fysisk aktivitet daglig. Gjennomsnittlig varighet var 3,2 år. Man fant at intervensjonsgruppen hadde en diabetesrisiko på 15 %, mens placebogruppens risiko var 38 %. Beregninger viser at fem personer må behandles i fem år for å forebygge diabetes hos én person.
Den forebyggende effekten av livsstilsintervensjon ble også studert i The Diabetes Prevention Project (DPP) (18), der 3 234 personer med glukoseintoleranse ble randomisert til metformin 850 mg to ganger daglig, livsstilsintervensjon eller placebo. Livsstilsintervensjonen inneholdt et intensivt undervisningsopplegg. Fettinntaket ble redusert først, deretter ble energibalanse etablert. Målet var en vektreduksjon på 7 %. Det ble lagt opp til 150 minutter moderat fysisk aktivitet ukentlig, med et energiforbruk på 700 kcal/uke (2 940 kJ/uke). 74 % av gruppen oppnådde dette og gikk gjennomsnittlig ned 7 kg i vekt. Diabetesinsidensen var 4,8 per 100 år i intervensjonsgruppen, mot 11,0 per 100 år i placebogruppen. Sju personer må behandles i tre år for å forebygge diabetes hos én person.
Kirurgi
De aktuelle metodene er gastrisk bypass, gastrisk innsnøring eller gastroplastikk (19). Adipositaskirurgi fører til redusert volum av magesekken, man blir dermed tidligere mett, eller føden ledes delvis forbi proksimale tynntarm, noe som gir redusert absorpsjon av næringsstoffer. Tidligere har man anbefalt adipositaskirurgi hos yngre pasienter (under 60 år) med alvorlig overvekt (BMI > 35) og komorbiditet som søvnapné, diabetes eller leddsykdom (20). Det er gastrointestinale bivirkninger ved alle disse inngrepene. Derfor er langtidsoppfølging nødvendig (19). Dødeligheten er ved bypass ca. 1 %, ved de øvrige metoder < 1 % (19).
I en svensk intervensjonsstudie undersøkte man effekten av kirurgi versus konvensjonell adipositasbehandling hos svært overvektige personer (21). Inklusjonen ble avsluttet i januar 2001. Så langt er 2 010 personer operert, og det er 2 037 i kontrollgruppen. Tiårsdata foreligger nå for 724 personer. Vekttapet to år etter operasjon var 28 kg. Vekttapet var størst etter «gastric bypass» (22). Ved konvensjonell behandling var vekttapet kun 0,5 kg. Imidlertid ser man mindre effekt etter som tiden går. Etter åtte år var vektendringen etter henholdsvis kirurgi og konvensjonell behandling – 20 kg og +0,7 kg. Det var 3,6 % diabetes i intervensjonsgruppen og 18,5 % i kontrollgruppen. Postoperativ dødelighet var 0,5 % hos de 2 010 opererte personene. Perioperative komplikasjoner inntraff hos 13 %.
Farmakologiske intervensjoner
Tabell 1 gir en oversikt over nyere studier av farmakologisk forebygging av type 2-diabetes (18, 23) – (25). Av størst interesse er kanskje metformin. I DPP-studien ble risikoen for type 2-diabetes redusert med 31 % i metformingruppen og 58 % i livsstilsintervensjonsgruppen (18). Henholdsvis 14 og sju personer måtte behandles i tre år for å forebygge diabetes hos én person. Metformin var like effektivt som livsstilsintervensjon hos personer med BMI > 35 eller alder 24 – 44 år (18). Effekten av metformin har også vist seg delvis å vare ved også etter seponering (26). Metformin var også mer effektivt ved høye verdier av fastende plasma-glukose (18). Imidlertid synes midlet å ha begrenset effekt på postprandial hyperglykemi (18). Vi vet fra tidligere studier (21) at kost- og livsstilsendringer hos alvorlig overvektige ofte ikke er nok. Personer som allerede i ung alder utvikler redusert glukosetoleranse eller har grensestatus, har muligens en annen genetisk belastning, selv om dette ikke kunne underbygges av subgruppeanalyser i DPP-studien.
Tabell 1
Studier omkring farmakologisk forebygging av type 2-diabetes
| Medikament (referanse) |
Antall |
Intervensjon |
Kumulativ diabetesinsidens |
| Metformin (18) |
3 234 Redusert glukosetoleranse + grensestatus |
Metformin 850 mg x 2 eller placebo |
7,8 % versus 11,0 % |
| Troglitazone (23) |
266¹ |
Livsstilsintervensjon + troglitazone 400 mg x 1 eller placebo |
5,4 % versus 12,1 % |
| Orlistat (24) |
4 193 21 % med redusert glukosetoleranse² |
Livsstilsintervensjon + orlistat 120 mg x 3 eller placebo |
6,2 % versus 9,0 % |
| Akarbose (25) |
1 429 Redusert glukosetoleranse |
Livsstilsintervensjon + akarbose 100 mg x 3 eller placebo |
32,4 % versus 41,5 % |
| [i] | |||
[i] ¹ Kvinner med tidligere svangerskapsdiabetes
² 79 % hadde normal glukosetoleranse, men var overvektige
Troglitazone er tatt av markedet grunnet fulminant leversvikt hos friske forsøkspersoner. Data fra TRIPOD-studien (tab 1) kan likevel tyde på at glitazoner reduserer insulinsresistensen hos kvinner med tidligere svangerskapsdiabetes (23). Det er så langt ikke publisert studier med andre glitazoner brukt for å forebygge type 2-diabetes.
Xendos-studien (tab 1) viste en positiv effekt av orlistat på diabetesinsidensen, imidlertid var det mange som ikke fullførte studien (24). Betydningen av vektreduksjon, eventuelt understøttet av medikamenter, som forebygging av type 2-diabetes kan ikke bestrides. I STOP-NIDDM-studien synes akarbose, i tillegg til vektreduksjon, å redusere postprandial hyperglykemi. Disse resultatene er også svekket av et betydelig frafall undeveis, mest i intervensjonsgruppen (25).
Teoretisk sett vil de fleste antidiabetika kunne tenkes brukt som forebyggende behandling. Sulfonylurea- og sulfonylurealiknende preparater øker insulinfrigjøringen. Imidlertid kan en farmakologisk stimulering av insulinfrigjøringen kanskje også bidra til den progredierende betacellesvikten ved type 2-diabetes (27).
Utvelgelse av screeningpopulasjon og tester
Personene som deltok i DPP-studien hadde BMI > 24, fastende plasma-glukose var 5,3 – 6,9 mmol/l og to timer etter peroral glukosebelastning 7,8 – 11,0 mmol/l (18). Beregninger viser at dersom disse inklusjonsvariablene anvendes på befolkningsnivå, ville ti millioner amerikanere være aktuelle for intervensjon. Med en så stor populasjon vil behovet for ressurser og logistikk være en betydelig utfordring for screening.
Kan man ut fra enkle kliniske variabler utpeke personer med høy risiko for type 2-diabetes? Stern og medarbeidere fant følgende uavhengige variabler i en multivariat analyse: fastende glukose, blodtrykk, BMI, triglyserider, familieanamnese og kolesterolnivå. Det viste seg at denne modellen predikerte risiko like godt som peroral glukosebelastning (28).
Saydah og medarbeidere har vist at screening med hevede terskelverdier (fastende plasma-glukose, Hb A1c) kan identifisere personer som er aktuelle for intervensjon med stor nøyaktighet (29).
Imidlertid må peroral glukosebelastning uansett gjøres hos screenede en eller annen gang for å utelukke type 2-diabetes (8). American Diabetes Association anbefaler så langt opportunistisk screening, spesielt hos dem med risikofaktorer som høy alder, overvekt og hjerte- og karsykdom. Intervensjon så langt er kun rådgivning og veiledning om vektreduksjon, økt fysisk aktivitet og videre oppfølging (30).
Diskusjon
Kanskje er det en forsinkelse av diabetesdebuten som skjer mer enn total forebygging – noe resultatene i adipositaskirurgistudien kan tyde på (21). Dersom klinisk diabetes bare utsettes et par år, vil totalprevalensen av sykdommen kun påvirkes marginalt. Likevel kan dette være betydningsfullt, siden senkomplikasjonene sannsynligvis også utsettes.
Livsstilsintervensjon var mest effektivt hos eldre over 60 år og hos individer med BMI < 30 kg/m2 (18). Det er med andre ord mulig å oppnå en effektiv livsstilsintervensjon hos eldre. I tillegg var effekten av intervensjonen signifikant større hos personer med lavgradig redusert glukosetoleranse (18), noe som kan tale for tidlig intervensjon.
Et felles problem for både farmakologiske og ikke-farmakologiske intervensjoner er at pasienten blir lei og ikke etterlever regimet. Det gjelder særlig i de tilfeller der det er bivirkninger ved behandlingen. Tall fra DPS-studien viser at kun ett av fem behandlingsmål ble oppnådd i mer enn 50 % av tilfellene i løpet av det første året, til tross for tett oppfølging (17). Behovet for screening og intervensjon kan være større i grupper som ikke deltar i studier (31).
Konklusjon
Primærforebygging av type 2-diabetes er mulig. Sannsynligvis vil risikoindivider best kunne identifiseres i primærhelsetjenesten ved hjelp av anamnese og enkle kliniske variabler (ramme 1). Imidlertid bør det utarbeides nasjonale retningslinjer for screening og intervensjon på linje med det finske handlingsprogrammet (32). Det er sentralt for helsetilstanden i befolkningen å forebygge overvekt og øke den fysiske aktiviteten.
Forslag til tiltak for forebygging av type 2-diabetes
Individer med høy risiko¹ bør identifiseres i primærhelsetjenesten, og intervensjon bør igangsettes der
Intervensjonsmål i risikogrupper: Oppnå et moderat varig vekttap (5 – 7 %) ved kostomlegging og økt fysisk aktivitet. Øke insulinfølsomheten ved hjelp av fysisk aktivitet
Virkemiddel: Etablere et nasjonalt handlingsprogram med fastlagt veiledning og oppfølging av intervensjoner. Kontroll for å fange opp eventuell diabetesutvikling bør gjøres hvert eller hvert annet år
Screening: Fastende blodsukker eller peroral glukosebelastning, positive funn skal retestes. Rescreening av disponerte personer¹ bør skje hvert tredje år
Nasjonalt handlingsprogram med strategi på befolkningsnivå, vektlegging av økt fysisk aktivitet og bedret kosthold, hovedvekt på intervensjon på bedrifts- og samfunnsnivå
¹ Familiær belastning, kjent nedsatt glukosetoleranse (inkludert befolkningsgrupper med høy diabetesrisiko), tidligere svangerskapsdiabetes, dyslipidemi, polycystisk ovarie-syndrom, koronarsykdom, BMI ≥25,0
Jeg takker Valdemar Grill for kommentarer til manuskriptet.
Oppgitte interessekonflikter:
Forfatter har mottatt reisetilskudd fra Novartis til American Diabetes Associations kongress i San Antonio, Texas, i 2000.
Oppgitte interessekonflikter: Se til slutt i artikkelen
Hovedbudskap
Type 2-diabetes kan forebygges hos personer med høy risiko for sykdommen
Primærforebygging kan skje ved livsstilsintervensjon i primærhelsetjenesten
Medikamentell forebygging er et tilleggsalternativ
- 1.
King H, Aubert RE, Herman WH. Global burden of diabetes, 1995 – 2025: prevalence, numerical estimates and projections. Diabetes Care 1998; 21: 1414 – 31.
- 2.
Midthjell K, Krüger O, Holmen J et al. Rapid changes in the prevalence of obesity and know diabetes in an adult Norwegian population: the North-Trøndelag Health Surveys 1984 – 1986 and 1995 – 1997. Diabetes Care 1999; 11; 1813 – 20.
- 3.
Diabetes complications. I: American Diabetes Association, red. Diabetes 2001 Vital Statistics. Alexandria, VA: American Diabetes Association, 2001: 43 – 74.
- 4.
Isomaa B, Almgren P, Tuomi T et al. Cardiovascular morbidity and mortality associated with the metabolic syndrome. Diabetes Care 2001; 24: 683 – 9.
- 5.
Mortality. I: American Diabetes Association, red. Diabetes 2001 Vital Statistics. Alexandria, VA: American Diabetes Association, 2001: 77 – 85.
- 6.
Jönsson B. CODE-2 Advisory Board. Revealing the cost of diabetes in Europe. Diabetologia 2002; 45: S5 – 12.
- 7.
Meigs JB, Muller DC, Nathan DM et al. The natural history from normal glucose tolerance to type 2-diabetes in the Baltimore Longitudinal Study of Aging. Diabetes 2003; 52: 1475 – 84.
- 8.
Grill V, Claudi T, Følling I et al. Nye diagnostiske kriterier for diabetes – hvorfor? Tidsskr Nor Lægeforen 2000; 120: 1876 – 7.
- 9.
De Vegt F, Dekker JM, Jager A et al. Relation of impaired fasting and postload glucose with incident type 2-diabetes in a Dutch population. The Hoorn study. JAMA 2001; 285: 2109 – 13.
- 10.
De Fronzo RA. Lilly lecture 1987. The triumvirate: beta cell, muscle, liver. A collusion responsible for NIDDM. Diabetes 1988; 37: 667 – 87.
- 11.
Markovic TP, Jenkins AB, Campbell LV et al. The determinants of glycemic responses to diet restriction and weight loss in obesity and NIDDM. Diabetes Care 1998; 21: 687 – 94.
- 12.
Houseknecht KL, Vanden Heuvel JP, Moya-Camarena SY et al. Dietary conjugated linoleic acid normalizes impaired glucose tolerance in the Zucker diabetic fatty fa/fa rat. Biochem Biophys Res Commun 1998; 244: 678 – 82.
- 13.
Hu FB, van Dam RM, Liu S. Diet and risk of type II diabetes: the role of types of fat and carbohydrate. Diabetologia 2001; 44: 805 – 17.
- 14.
Nakanishi N, Suzuki K, Tatara K. Alcohol consumption and risk of impaired fasting glucose or type 2-diabetes in middle-aged Japanese men. Diabetes Care 2003; 26: 48 – 54.
- 15.
Persson PG, Carlsson S, Svanström L et al. Cigarette smoking, oral moist snuff use and glucose intolerance. J Intern Med 2000; 248: 103 – 10.
- 16.
Eriksson KF, Lindegarde F. Prevention of type 2 (non-insulin dependent) diabetes by diet and physical exercise. The 6-year Malmö feasibility study. Diabetologia 1991; 34: 891 – 8.
- 17.
Tuomilehto J, Lindström J, Eriksson JG et al. Prevention of type 2-diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. N Engl J Med 2001; 344: 1343 – 9.
- 18.
Diabetes Prevention Program Research Group. Reduction in the incidence of type 2-diabetes with lifestyle intervention or metformin. N Engl J Med 2002; 346: 393 – 403.
- 19.
Summers LKM. Is surgery the best treatment for type 2 diabetes in the obese? Diabet Med 2002; 19 (suppl 3): 14 – 7.
- 20.
NIH Conference. Gastrointestinal surgery for severe obesity. Consensus Development Conference Panel. Ann Intern Med 1991; 115: 956 – 61.
- 21.
Sjöström CD. Surgery as an intervention for obesity. Results from the Swedish obese subjects study. Growth Horm IGF Res 2003; 13 (suppl A): S22 – 6.
- 22.
Sjöström CD, Peltonen M, Wedel H et al. Differentiated long-term effects of international weight loss on diabetes and hypertension. Hypertension 2000; 36: 20 – 5.
- 23.
Buchanan TA, Xiang AH, Peters RK et al. Preservation of pancreatic beta-cell function and prevention of type 2-diabetes by pharmacological treatment of insulin resistance in high-risk Hispanic women. Diabetes 2002; 51: 2796 – 803.
- 24.
Torgerson JS, Hauptman J, Boldrin MN et al. Xenical in the prevention of diabetes in obese subjects (XENDOS) study. Diabetes Care 2004; 27: 155 – 61.
- 25.
Chiasson J-L, Josse RG, Gomis R et al. Acarbose for the prevention of type 2-diabetes mellitus; the STOP-NIDDM randomised trial. Lancet 2002; 359: 2072 – 7.
- 26.
The Diabetes Prevention Program research group. Effects of withdrawal of metformin on the development of diabetes in the Diabetes Prevention Program. Diabetes Care 2003; 26: 977 – 80.
- 27.
Alvarsson M, Sundkvist G, Lager I et al. Beneficial effects of insulin versus sulphonylurea on insulin secretion and metabolic control in recently diagnosed type 2 diabetic patients. Diabetes Care 2003; 26: 2231 – 7.
- 28.
Stern MP, Williams K, Haffner SM. Identification of persons at high risk for type 2-diabetes mellitus: do we need the oral glucose tolerance test? Ann Intern Med 2002; 136: 575 – 61.
- 29.
Saydah SH, Byrd-Holt D, Harris MI. Projected impact of implementing the result of the Diabetes Prevention Program in the U.S. population. Diabetes Care 2002; 25: 1940 – 5.
- 30.
American Diabetes Association, National Institute of Diabetes, Digestive and Kidney Diseases. The prevention or delay of type 2 diabetes. Position statement. Diabetes Care 2003; 26: S62 – 9.
- 31.
Nilsson P, Berglund G. Prevention of cardiovascular disease and diabetes: lessons from the Malmö Preventive Project. J Intern Med 2000; 248: 455 – 62.
- 32.
Finnish Diabetes Association. Development programme for the prevention and care of diabetes in Finland 2000 – 2010. www.diabetes.fi/english/programme/ (17.10.2003).