Background.
Mammograms are useful in identifying early breast cancers before they become palpable, but they can also give us information about mammographic density, a strong risk factor for breast cancer. Mammographic density has been suggested as a biomarker for breast cancer risk and is currently being used as a surrogate endpoint for breast cancer in several cancer prevention trials.
Material and methods.
This article summarises the rationale for using mammographic density as a surrogate endpoint for breast cancer, with an emphasis on the results that have been published over the last decade.
Results.
Mammographic density not only represents a strong risk factor for breast cancer, it is also modifiable. Mammograms are non-invasive and mammographic density is readily assessed using computer-assisted methods.
Interpretation.
The ultimate question that remains to be answered is whether a change in mammographic density translates to a change in breast cancer risk. This question could easily be addressed in the Norwegian Breast Cancer Screening Programme if participants were asked the necessary questions when attending the screening programme.
Kliniske randomiserte undersøkelser av intervensjoner som kan påvirke risikoen for sykdommer som brystkreft er svært kostbare. Women’s Health Initiative (WHI)-studien (1), som ble publisert i 2002, er et godt eksempel. I denne undersøkelsen ble ca. 16 000 kvinner randomisert til å få østrogen og progestogen eller placebo. De ble fulgt i gjennomsnittlig 5,2 år før undersøkelsen ble stoppet og man konkluderte med at risikoen for brystkreft økte med ca. 5 % per år hormonene var brukt. Det diskuteres nå i fagkretser om andre østrogener og progestogener, forskjellige administreringsformer og lavere doser ville ha gitt andre resultater. Betyr dette at vi må bruke flere hundre millioner kroner til på en ny femårig klinisk undersøkelse for å se om et annet medikament vil ha mindre effekt på forekomsten av brystkreft? For oss i Skandinavia, som forskriver andre hormoner enn de som blir brukt i USA, er det lite sannsynlig at vi ville kunne skaffe økonomiske midler til en slik dyr undersøkelse. Vi trenger derfor en brukbar biomarkør som kan brukes som surrogat for brystkreft, slik at vi i stedet for å følge titusener av kvinner over flere år, kunne undersøke noen få hundre kvinner over en mye kortere periode, kanskje ett år.
Krav til en biomarkør (biologisk markør)
Kanadiske forskere (2) har tidligere satt opp en del krav som må tilfredsstilles dersom mammografisk tetthet skal kunne brukes som surrogat for brystkreft i intervensjonsstudier. Mammografisk tetthet bør være:
En sterk risikofaktor for brystkreft
Vanlig hos dem som utvikler brystkreft
Modifiserbar
Ikke-invasiv og lett tilgjengelig
Ha en biologisk betydning
I det følgende diskuteres hvorvidt mammografisk tetthet tilfredsstiller disse kravene.
Definisjon av mammografisk tetthet og målemetoder
Hvordan mammogrammet ser ut, avhenger av mengden radiotett vev (epitelvev, bindevev) og fettvev i brystet. Mammografisk tetthet ble opprinnelig ofte klassifisert i parenkymmønstre. Flere slike er beskrevet (3, 4). Den mest kjente klassifikasjonen ble utviklet av radiologen John Wolfe (3). Ifølge dette systemet representerer N1-mønsteret et mammogram med nesten bare fettvev, mens P1- og P2-mønstrene inneholder økende duktal prominens, og DY-mønsteret diffuse og uttalte nodulære tettheter. Mønstrene P2 og DY har vist seg å være forbundet med risiko for brystkreft (5). Men klassifisering var vanskelig og metoden forbundet med stor interobservatørvariasjon.
De fleste forskere har etter hvert gått over til prosent mammografisk tetthet (5). Noen har brukt en grov subjektiv klassifiseringsmetode, hvor en radiolog klassifiserer hvert mammogram etter én av fire predefinerte kategorier av prosent mammografisk tetthet. Metoder som gir et kontinuerlig mål på tetthet brukes imidlertid mer. Wolfe og medarbeidere beskrev en enkel metode (6), som senere er blitt avløst av dataassisterte målinger. Disse metodene er ikke automatiske, men dataassisterte, og krever en øvet avleser som er grundig testet. En vanlig brukt metode ble utviklet i Canada (7). Vi har ved University of Southern California utviklet en liknende metode (Madena) (8) (fig 1).
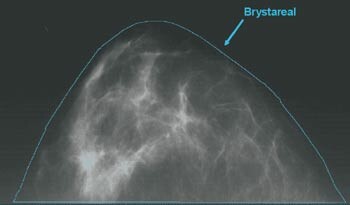
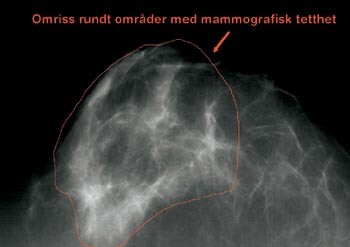
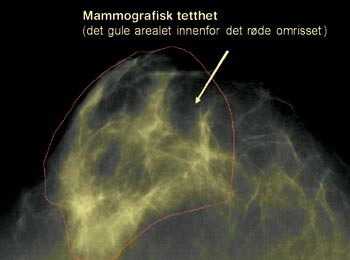
Kraniokaudale mammogrammer skannes på en minimum 8-bit (256 gråtoner) skanner. Bildet importeres til dataprogrammet Madena. Operatøren tegner omrisset rundt brystet på skjermen og programmet måler arealet (fig 1a). Tettheten måles ved at operatøren først tegner et omriss rundt områdene med tett mammavev (fig 1b), man ekskluderer på denne måten lyse artefakter som vener, ligamenter og eventuelt m. pectoralis. Deretter fargelegger operatøren lyse områder innenfor omrisset som hun/han mener representerer mammografisk tetthet (fig 1c). Programmet beregner størrelsen på det fargelagte arealet, og man kan regne ut prosent tetthet ved å dele dette arealet med brystarealet.
Mammografisk tetthet og brystkreftrisiko
En rekke undersøkelser har vist at høy mammografisk tetthet er en sterk uavhengig risikofaktor for brystkreft (2, 5, 7, 9, 10). Sammenliknet med kvinner som har svært lav eller ingen mammografisk tetthet, har kvinner med høy tetthet 4 – 6 ganger så høy risiko for å utvikle brystkreft (tab 1). Prosent mammografisk tetthet gir sterkere risikoestimater for brystkreft enn Wolfes parenkymmønstre (9). Bortsett fra alder og visse genetiske mutasjoner er mammografisk tetthet den sterkeste kjente risikofaktoren for brystkreft.
Tabell 1
Prosentandel av krefttilfeller med høy mammografisk tetthet og relativ risiko (95 % konfidensintervall) for brystkreft hos kvinner med høy tetthet sammenliknet med 0 % mammografisk tetthet i tre store undersøkelser
| Prosentandel av krefttilfellene som oppstod i bryst med høy mammografisk tetthet |
Relativ risiko (95 % konfidensintervall) forbundet med tetthet på |
||||||
| Forfatter |
Alder (år) |
Brystkrefttilfeller/kontrollpersoner |
>= 50 % mammografisk tetthet |
>= 75 % mammografisk tetthet |
50 – 74 % |
75 % og høyere |
|
| Byrne (9) |
Ca. 40 – over 60 |
1 880/2 152 |
53 % |
10 % |
2,8 (2,1 – 3,6) |
4,4 (3,1 – 6,1) |
|
| Boyd (7) |
40 – 59 |
354/354 |
44 % |
19 % |
3,4 |
4,0 – 6,1¹ |
|
| Ursin (10) |
35 – 64 |
622/443 |
31 %² |
3 % |
3,2 (1,7 – 6,3) |
5,2 (1,7 – 16,1) |
|
| [i] | |||||||
[i] ¹ Avhengig av om estimatet var dataassistert eller subjektive kategorier
² Metoden brukt i denne studien gir generelt lavere verdier for tetthet enn de to andre
10 – 30 % av brystkrefttilfellene oppstår hos kvinner med høy mammografisk tetthet. Det er et kontinuerlig dose-respons-forhold mellom tetthet og brystkreftrisiko. For hver 10 % økning i tetthet øker risikoen for brystkreft med 15 – 20 % (7, 10).
Mammografisk tetthet kan modifiseres
Tettheten er til en viss grad arvelig (11), men kan også modifiseres (tab 2) (8, 12) – (15). Den forandrer seg med alderen, og reduseres med ca. 5 % etter menopause (12). En reduksjon i det endogene hormonnivået reduserer mammografisk tetthet. I en randomisert placebokontrollert undersøkelse viste vi at et hormonelt regime som reduserer østrogen-, progesteron- og testosteronnivået gir en betydelig reduksjon (6 %) i mammografisk tetthet etter ett år (8, 13, 16).
Tabell 2
Endringer i mammografisk tetthet i ulike situasjoner
| Situasjon eller intervensjon |
Menopausalgruppe |
Absolutt endring i prosent mammografisk tetthet |
| Menopause (12) |
Pre- og postmenopausale¹ |
–3 |
| Gonadotropinfrigjørende hormonagonist (8, 13, 14) |
Premenopausale |
–6,5 |
| Tamoksifen (15) |
Pre- og postmenopausale |
–5,8 |
| Premenopausale |
–8,5 |
|
| Postmenopausale |
–2,2 |
|
| Kombinert østrogen og progestin (18) |
Postmenopausale |
+4 – 5² |
| [i] | ||
[i] ¹ Sammenlikning av de samme kvinnene før og etter gjennomgått menopause
² Ulike regimer gav noe ulik effekt
Hos noen kvinner ses små forandringer i tettheten i løpet av en menstruasjonssyklus (17). Kliniske undersøkelser av mammografitetthet hos premenopausale kvinner må derfor standardiseres i forhold til menstruasjonssyklusen.
I en pilotundersøkelse fant vi at tamoksifen reduserer mammografisk tetthet (18), og dette er senere bekreftet av Brisson og medarbeidere (15), som fant at tettheten var 6 % lavere hos kvinner som var randomisert til 20 mg tamoksifen daglig i ett år sammenliknet med dem som fikk placebo.
Mammografisk tetthet øker hos mange postmenopausale kvinner som begynner med østrogen og progestogen. Økningen finner sted i løpet av ett år. I Postmenopausal Estrogen and Progestin Intervention (PEPI)-undersøkelsen fant vi at tettheten økte med gjennomsnittlig 5 % i gruppen randomisert til det vanligste amerikanske østrogenet (ekvint østrogen) kombinert med enten medroksyprogesteronacetat eller mikronisert progestogen, mens det var en ikke-signifikant økning på kun 1 % hos kvinner som fikk østrogen alene (19). Økningen i mammografisk tetthet ved kombinert bruk av østrogen og progestogen er altså i størrelsesorden med reduksjonen i tetthet observert for tamoksifen.
Mammografisk tetthet – biologisk forklaring
Histopatologiske undersøkelser indikerer at høy tetthet først og fremst er forbundet med fibrose (2). Vekstfaktorer i stroma har betydning for celledelingen i brystepitelet. Kvinner med høy tetthet har høyere nivå av vekstfaktorer i bryststromaet (20). Premenopausale kvinner med høy mammografisk tetthet har høyere nivå av insulinvekstfaktor (21). Tettheten kan også være et mål på økt celledeling i epitelvevet i brystet (13). Kvinner som har høy tetthet har mer celleatypi og høyere risiko for å utvikle atypisk hyperplasi eller carcinoma in situ enn kvinner med liten tetthet (22).
Vil forandringer i mammografisk tetthet medføre forandringer i risiko?
Dersom vi vil være sikre på at mammografisk tetthet er en solid biomarkør som kan brukes som surrogat for brystkreft, bør vi undersøke om kvinner som får en reduksjon i tetthet når de begynner med f.eks. tamoksifen, er beskyttet mot brystkreft, og om kvinner som får økt tetthet ved oppstart av hormonbehandling, er de som utvikler brystkreft. Spørsmålet ville enkelt kunne besvares dersom de nødvendige opplysningene ble samlet inn i det landsomfattende mammografiscreeningprosjektet i Norge. Hittil har deltakerne kun fått et enkelt spørreskjema første gang de kommer til screeningen. Der er de blant annet blitt spurt om de har brukt hormonpreparater. Dette er utilstrekkelig for å besvare disse spørsmålene. Det offentlige mammografiprogrammet med en sentral database gir en unik mulighet til å drive forskning omkring mammografisk tetthet. Men dette krever at kvinnene ved hver screening systematisk blir spurt om hva de bruker av hormoner, samt at noe tilleggsinformasjon samles inn, blant annet om hva de har brukt før. I tillegg må tettheten avleses.
Diskusjon
Mammografisk tetthet er en sterk, uavhengig risikofaktor for brystkreft, den er modifiserbar, og den er antakelig forbundet med celledeling i brystet. Fordi tettheten kan bestemmes ut fra et vanlig screeningmammogram, er den også relativt tilgjengelig. For radiologer er det sannsynligvis enklest å bestemme mammografisk tetthet ved å benytte en subjektiv kategorisering idet de leser mammogrammene. Dette er imidlertidig en insensitiv metode, som ikke vil fange opp små forandringer. En slik kategorisering vil heller ikke kunne sammenliknes med det vi vet om endringer som inntreffer ved behandling med tamoksifen, østrogen og progestogen, og ved menopause. For å finne mindre forandringer må mammogrammene skannes og tettheten avleses med en dataassistert metode av en erfaren avleser.
Mammografisk tetthet har allerede vært brukt som surrogat for brystkreft i undersøkelser av tamoksifen (15), raloksifen (14), tibolon (14) og aromatasehemmere (23). Med de forbehold som er diskutert, tyder resultatene på at dette er fornuftig. Mammografisk tetthet forandres raskt, og bruken av denne indikatoren bør utvides dersom vi vil ha raske svar på om nye behandlinger virker.
Det er imidlertid verdt å minne om at den «endelige» testen fremdeles gjenstår, nemlig om forandringer i tetthet medfører endret risiko. Det spørsmålet bør kunne besvares i Norge dersom de nødvendige data blir samlet inn som ledd i det nasjonale programmet for mammografiscreening.
Interessekonflikter: Ingen
- 1.
Rossouw JE, Anderson GL, Prentice RL, LaCroix AZ, Kooperberg C, Stefanick ML et al. Risks and benefits of estrogen plus progestin in healthy postmenopausal women. Principal results from the Women’s Health Initiative randomized controlled trial. JAMA 2002; 288: 321 – 33.
- 2.
Oza AM, Boyd NF. Mammographic parenchymal patterns: a marker of breast cancer risk. Epidemiol Rev 1993; 15: 196 – 208.
- 3.
Wolfe J. Breast patterns as an index of risk for developing breast cancer. AMJ Am J Roentgenol 1976; 126: 1130 – 9.
- 4.
Gram IT, Funkhouser E, Tabar L. The Tabar classification of mammographic parenchymal patterns. Eur J Radiol 1997; 24: 131 – 6.
- 5.
Saftlas AF, Szklo M. Mammographic parenchymal patterns and breast cancer risk. Epidemiol Rev 1987; 9: 146 – 74.
- 6.
Wolfe JN, Saftlas AF, Salane M. Mammographic parenchymal patterns and quantitative evaluation of mammographic densities: a case-control study. Am J Radiology 1987; 148: 1087 – 92.
- 7.
Boyd NF, Byng J, Jong R, Fishell E, Little L, Miller AB et al. Quantitative classification of mammographic densities and breast cancer risks: results from the Canadian National Breast Screening Study. J Natl Cancer Inst 1995; 87: 670 – 5.
- 8.
Ursin G, Astrahan MA, Salane M, Parisky YR, Pearce JG, Daniels JR et al. The detection of changes in mammographic densities. Cancer Epidemiol Biomarkers Prev 1998; 7: 43 – 7.
- 9.
Byrne C, Schairer C, Wolfe J, Parekh N, Salane M, Brinton LA et al. Mammographic features and breast cancer risk: effects with time, age and menopause status. J Natl Cancer Inst 1995; 87: 1622 – 9.
- 10.
Ursin G, Ma H, Wu AH, Bernstein L, Salane M, Parisky YR et al. Mammographic density and breast cancer in three ethnic groups. Cancer Epidemiol Biomarkers Prev 2003; 12: 332 – 8.
- 11.
Boyd NF, Dite GS, Stone J, Gunasekara A, English DR, McCredie MR et al. Heritability of mammographic density, a risk factor for breast cancer. N Engl J Med 2002; 347: 886 – 94.
- 12.
Boyd NF, Martin L, Stone J, Little L, Minkin S, Yaffe M. A longitudinal study of the effects of menopause on mammographic features. Cancer Epidemiol Biomarkers Prev 2002; 11: 1048 – 53.
- 13.
Spicer DV, Ursin G, Parisky YR, Pearce JG, Shoupe D, Pike A et al. Changes in mammographic densities induced by a hormonal contraceptive designed to reduce breast cancer risk. J Natl Cancer Inst 1994; 86: 431 – 6.
- 14.
Christodoulakos GE, Lambrinoudaki IV, Vourtsi AD, Panoulis KP, Kelekis DA, Creatsas GC. Mammographic changes associated with raloxifene and tibolone therapy in postmenopausal women: a prospective study. Menopause 2002; 9: 110 – 6.
- 15.
Brisson J, Brisson B, Cote G, Maunsell E, Berube S, Robert J. Tamoxifen and mammographic breast densities. Cancer Epidemiol Biomarkers Prev 2000; 9: 911 – 5.
- 16.
Gram IT, Ursin G, Spicer DV, Pike MC. Reversal of gonadotropin-releasing hormone agonist induced reductions in mammographic densities on stopping treatment. Cancer Epidemiol Biomarkers Prev 2001; 10: 1117 – 20.
- 17.
Ursin G, Parisky YR, Pike MC, Spicer DV. Mammographic density changes during the menstrual cycle. Cancer Epidemiol Biomarkers Prev 2001; 10: 141 – 2.
- 18.
Ursin G, Spicer DV, Pike MC. Tamoxifen and prevention. Lancet 1993; 341: 693 – 5.
- 19.
Greendale GA, Reboussin BA, Slone S, Wasilauskas C, Pike MC, Ursin G. Postmenopausal hormone therapy and change in mammographic density. J Natl Cancer Inst 2003; 95: 30 – 7.
- 20.
Guo YP, Martin LJ, Hanna W, Banerjee D, Miller N, Fishell E et al. Growth factors and stromal matrix proteins associated with mammographic densities. Cancer Epidemiol Biomarkers Prev 2001; 10: 243 – 8.
- 21.
Byrne C, Hankinson SE, Pollak M, Willett WC, Colditz GA, Speizer FE. Insulin-like growth factors and mammographic density. Growth Horm IGF Res 2000; 10 (suppl A): S24 – 5.
- 22.
Boyd NF, Jensen HM, Cooke G, Han HL. Relationship between mammographic and histological risk factors for breast cancer. J Natl Cancer Inst 1992; 84: 1170 – 9.
- 23.
Fabian CJ, Kimler BF, Brady DA, Mayo MS, Chang CH, Ferraro JA et al. A phase II breast cancer chemoprevention trial of oral alpha-difluoromethylornithine: breast tissue, imaging, and serum and urine biomarkers. Clin Cancer Res 2002; 8: 3105 – 17.