Background.
In randomised trials, treatment with anti-tumour necrosis factor alpha drugs has been shown to be efficacious for patients with rheumatoid arthritis. We analysed the effectiveness and toxicity of etanercept treatment in our day-to-day rheumatology practice at the University Hospital of Northern Norway.
Material and methods.
Patients with active polyarthritis who had failed at least three different disease-modifying anti-rheumatic drugs including methotrexate and/or combination therapy were consecutively included in an open study when they started etanercept therapy (25 mg twice per week subcutaneously). During follow up we noted the number of swollen and tender joints, took visual analogue scores (0 – 100 millimetre) for pain and global well-being, administered the Modified Health Assessment Questionnaire, performed laboratory tests, and took note of side effects.
Results.
BetweenApril 1999 and July 2001, etanercept treatment was initiated in 71 patients. An ACR-20 response (20 % improvement according to American College of Radiology criteria) occurred in 57 % of patients after one month of treatment and in 70 % after three months, ACR-50 response in 24 % and 42 %, and ACR-70 response in 6 % and 20 %. While half of all patients reported side effects, only five patients (7 %) discontinued treatment because of them.
Interpretation.
Etanercept is effective therapy for many patients with severe chronic polyarthritis in clinical practice. Short-term side effects occur more frequently than reported and seem less frequent with concomitant methotrexate therapy. Long-term side effects are still unknown and require close monitoring.
Hovedbudskap
Tumornekrosefaktor-alfa er en hovedaktør i inflammasjonsprosessen ved de fleste kroniske artrittsykdommer, som f.eks. revmatoid artritt
Etanercept, som hemmer tumornekrosefaktor-alfa viste seg i denne åpne studien fra klinisk praksis å være like effektivt, men noe mer toksisk enn i utprøvende studier hos pasienter med kronisk polyartritt
Spørsmålet om mulige langtidsvirkninger kan kun besvares gjennom nøye oppfølging av pasienter med kronisk polyartritt som får denne type behandling
Kostnadseffektivitet ved bruk av slike kostbare medisiner er ikke avklart
Revmatoid artritt er den vanligste av de kroniske polyartrittsykdommene, med en prevalens på omkring 0,5 % (1), og med en årlig insidens på 28,7/100 000 i Nord-Norge (2). Samtidig er det en betraktelig andel av pasienter med seronegative spondylartropatier (som f.eks. psoriasisartritt og Bekhterevs sykdom) som også kan utvikle kronisk polyartritt. Den totale prevalens av polyartritt-sykdommer ligger således rundt 1 % av befolkningen (3). Varighet av inflammasjon i individuelle ledd er en god prediktor for senere destruksjon av leddene, og erosjonsprosessen begynner ganske tidlig i sykdomsforløpet (4). Standardisert dødelighetsratio for pasienter med revmatoid artritt er forhøyet (2,2 – 2,7) og levetidsprognosen for disse er sammenliknbar med den hos pasienter med trekars koronarlidelse og non-Hodgkins lymfom (5) – (7). Den økte dødeligheten skyldes hovedsakelig overhyppighet av kardiovaskulære hendelser, som korreleres til den kroniske inflammasjonsprosessen ved revmatoid artritt (8, 9). Dette har ført til at behandlingen for pasientene er blitt langt mer aggressiv i de siste tiår og at man nå vektlegger maksimal supprimering av sykdomsaktiviteten, på et så tidlig tidspunkt som mulig (10). Patofysiologien bak revmatoid artritt er kompleks, men tumornekrosefaktor alfa (TNF-alfa) er en av de viktigste mediatorene i inflammasjonskaskaden (11, 12). Dette proinflammatoriske cytokinet finnes i høye konsentrasjoner i serum og leddvæske hos pasienter med aktiv revmatoid artritt og hemming av TNF-alfa har vist seg effektivt for å redusere eksperimentelle former av polyartritt (13) – (15).
Utprøvende behandling med anti-TNF-alfa-midler på pasienter med revmatoid artritt har vist til dels svært lovende resultater. To preparater er tilgjengelig for klinisk bruk: etanercept (Enbrel) og infliximab (Remicade) har vist tilsvarende effekter i den eksperimentelle utprøvning, til tross for at de interfererer med TNF-alfa på litt forskjellige måter (16, 17). Siden dette gjaldt behandling av de dårligste revmatoid artritt pasienter er disse resultater oppsiktsvekkende.
Relativt få artikler har hittil rapportert om anvendelse av anti-TNF-alfa-behandling (effekt og bivirkninger) i den kliniske hverdag. Denne behandlingssituasjonen skiller seg klart fra randomiserte studier med spesifikke inklusjons- og eksklusjonskriterier for deltakelse og behandling. Det er derfor viktig at kliniske erfaringer sammenliknes med resultater fra slike studier. Denne artikkelen presenterer våre første erfaringer med bruk av etanercept hos pasienter med aktiv polyartritt ved Revmatologisk avdeling, Universitetssykehuset Nord-Norge.
Pasienter og metoder
Pasienter
Alle pasienter som begynte med etanerceptbehandling fra april 1999 til juli 2001, ble fortløpende inkludert i en åpen studie. Pasientene hadde aktiv polyartritt ved oppstart, definert som minst to av følgende fire kriterier: >= 6 hovne og/eller ømme ledd, morgenstivhet > 1 time, og vedvarende forhøyet SR og/eller CRP, til tross for pågående behandling. Alle hadde hatt enten manglende effekt eller bivirkninger av minst tre ulike sykdomsmodifiserende antirevmatiske midler inklusive metotreksat og/eller hadde forsøkt kombinasjonsterapi av forskjellige slike midler. Pasienter med tidligere cancer og residiverende eller nylige, alvorlige infeksjonstilstander ble ekskludert. Før oppstart ble antall hovne og ømme ledd undersøkt (40-leddsskåre), og VAS-skåre (0 – 100 mm) for smerter og global sykdomspåvirkning (pasient og lege) ble registrert. Dessuten ble MHAQ (Modified Health Assessment Questionnaire), som er et forenklet, generisk mål for funksjonsstatus hos pasientene (18, 19) evaluert.
Etanerceptbehandling (25 mg × 2 subkutant per uke) ble igangsatt i sykehusavdelingen eller på poliklinikken, hvor pasientene fikk nødvendig opplæring i sprøytesettingsteknikk. Alle pasienter ble informert om behandlingen samt mulige bivirkninger av den, og gav sitt samtykke. Etter behandlingsstart ble pasientene kontrollert hver annen uke i to måneder, månedlig i fire måneder og senere hver tredje måned. Ved kontroller ble de samme parametere som ved oppstart registrert, og samtidig ble bivirkninger notert. Blodprøver ble tatt for bestemmelse av hemoglobin, leukocytter og trombocytter, SR, CRP, leverenzymer, serum-kreatinin og ANA. Ved alvorlige bivirkninger, eller dersom pasienten ikke hadde opplevd en klar klinisk bedring (uavhengig av oppnådd ACR-respons) etter tre måneder, ble behandlingen avsluttet.
Dataanalyse
Alle data ble registrert og analysert ved hjelp av dataprogrammet EpiInfo versjon 6.04 (CDC, Atlanta). Dataanalysen tok utgangspunkt i behandlingsintensjonsprinsippet, som innebærer at alle pasienter som begynte behandlingen, ble regnet med i analysene. For å vurdere behandlingsresponsen benyttet vi ACR-responskriteriene ved revmatoid artritt. Man definerer en ACR-respons på 0; 20; 50 eller 70 ved en tilsvarende prosentvis forbedring av hovne og ømme ledd, samt forbedring for tre av følgende fem variabler: funksjonsnivå (MHAQ), pasientens vurdering av smerte og sykdomsaktivitet (VAS), legens vurdering av sykdomsaktivitet (VAS) og inflammatorisk aktivitet (SR/CRP). Forskjeller mellom responsgrupper på de forskjellige tidspunktene ble analysert med ikke-parametriske tester (khikvadrattest, med Yates korreksjon om nødvendig, og Mann-Whitneys U-test). Forskjeller med resulterende p-verdier <= 0,05 ble betraktet som signifikante.
Resultater
Tabell 1 viser data for de 71 inkluderte pasientene. Revmatoid artritt var hoveddiagnosen hos 77 % av pasientene, mens 23 % hadde en spondylartropati med revmatoid artritt-liknende manifestasjoner. Alders- og kjønnsfordeling var som forventet ved disse sykdommene, og pasientene hadde ganske aktiv sykdom til tross for at mange brukte metotreksat (n = 37) og/eller prednisolon (n = 44). Gjennomsnittlig oppfølgingstid var ni måneder (variasjonsbredde 6,3 måneder), inkludert pasienter som måtte slutte pga. manglende effekt og/eller bivirkninger. 11 pasienter seponerte pga. manglende effekt, og den gjennomsnittlige behandlingstiden hos disse var 8,3 måneder (variasjonsbredde 5,0). 45 pasienter ble fulgt i over seks måneder og 20 pasienter i over 12 måneder.
Tabell 1
Data for inkluderte pasienter ved oppstart av etanerceptbehandlingen. Tall representerer medianverdier med mindre annet fremgår
| Parameter |
Verdi |
Variasjonsbredde |
| Alder (år) |
48 |
(20 – 81) |
| Kjønn (antall menn/kvinner) |
22/50 |
|
| Diagnose (antall med revmatoid artritt/psoriasisartritt/ Bekhterevs sykdom) |
55/14/2 |
|
| Sykdomsvarighet (md.) |
130 |
(17 – 280) |
| MHAQ¹ |
2 |
(1 – 4) |
| Morgenstivhet (min) |
120 |
(10 – 720) |
| Smerteintensitet (mm på VAS)² |
70 |
(20 – 100) |
| Pasientens sykdomsvurdering (mm på VAS) |
80 |
(10 – 100) |
| Legens sykdomsvurdering (mm på VAS) 2 |
60 |
(20 – 100) |
| Antall hovne ledd |
10 |
(1 – 30) |
| Antall ømme ledd |
15 |
(1 – 40) |
| SR mm |
35 |
(2 – 120) |
| CRP (mg/l) |
26 |
(2 – 220) |
| Metotreksat (mg/uke) (n = 37) |
10 |
(5,0 – 17,5) |
| Prednisolon (mg/dag) (n = 44) |
7,5 |
(5 – 20) |
| [i] | ||
[i] ¹ Modified Health Assessment Questionnaire
² 100 mm visuell analog skala
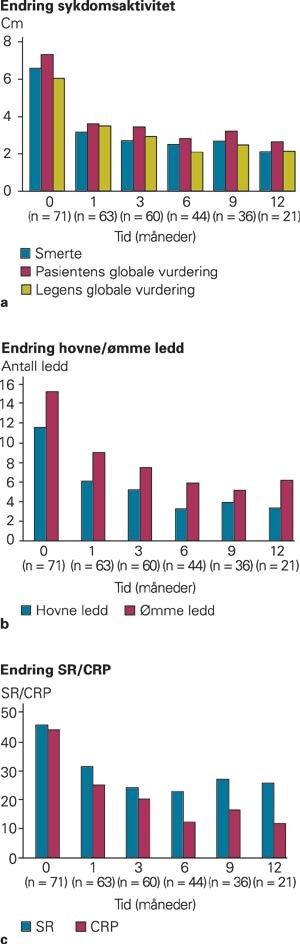
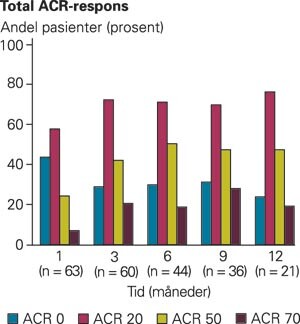
Forløpet av objektive og subjektive sykdomsaktivitetsmål (fig 1a) viser en nokså rask innsettende bedring av smerte og sykdomspåvirkning (pasients og leges vurdering). Verdier for disse tre parametere var signifikant bedre på alle kontrolltidspunkter enn ved oppstart (alle p-verdier < 0,05). Verdiene etter en, tre, seks og ni måneder var ikke signifikant forskjellige fra hverandre. Det samme gjaldt morgenstivheten, som ble redusert fra over to timer til under en halv time etter seks måneder, og utviklingen av MHAQ (p < 0,05). Parallelt med denne subjektive forbedring fant vi en signifikant reduksjon i antall hovne og ømme ledd (fig 1b). Nivået av CRP ble også signifikant redusert (alle verdier signifikant lavere enn initial verdi, p < 0,05; fig 1c). Utviklingen i den samlede vurdering av behandlingseffekten (ACR-responskriteriene) vises i figur 2. Etter en måned med etanerceptbehandlingen hadde 57 % av pasientene oppnådd en ACR-20-respons, og etter tre måneder var den tilsvarende andel 70 %. Andelen av pasienter med ACR-50-respons var henholdsvis 24 % og 42 %, og for ACR-70-respons var tallene 6 % og 20 % etter henholdsvis en og tre måneder. Blant alle pasienter med minst ACR-20-respons etter tre måneders behandling, erfarte noen en gradvis minkende effekt. Etter 12 måneder hadde 24 % ikke lenger effekt av behandlingen vurdert ut i fra ACR-20-responskriteriene. Dersom vi tok hensyn til underliggende diagnose, fant vi at 79 % av pasientene med psoriasisartritt hadde oppnådd ACR-20-respons etter tre måneders behandling (11/14), mot 63 % av revmatoid artritt-pasientene (27/43). Andelen pasienter med ACR-70-respons var høyere for psoriasisartritt (42 % og 27 %) enn ved revmatoid artritt (14 % og 16 %) etter tre og seks måneder (data ikke vist).
Bivirkninger
Av pasientene som ble behandlet med etanercept, rapporterte hele 48 % en eller annen bivirkning. De fleste av disse var milde og til dels uspesifikke (tretthet, hoste, lokalt erytem, myalgi, sår hals, tremor, munnsår, akne, nesetetthet, brystsmerter), men fem pasienter måtte seponere behandlingen pga. bivirkninger. Alle disse utviklet et urtikarielt utslett (tre i 2. behandlingsuke, en i 5. uke og en i 12. uke). Ingen av disse pasientene hadde brukt metotreksat i kombinasjon med etanercept, mens alle brukte lav dose prednisolon. Ingen av de 37 pasienter som brukte etanercept i kombinasjon med metotreksat måtte seponere medikamentet grunnet bivirkninger (p = 0,05).
Diskusjon
Biologisk behandling av kronisk polyartritt er blitt en realitet, og selv om sykdommen ikke helbredes, er det for første gang gitt en mulighet for rasjonell, rask og spesifikk demping av immunresponsen hos disse pasienter (14). Etanercept er et molekylærbiologisk fremstilt fusjonsprotein som består av to identiske kjeder av den rekombinante, humane, ekstracellulære TNF-alfa-reseptor p75-monomer, som er bundet til det konstante domenet av humant IgG1. Proteinet binder løselig TNF-alfa og reduserer derved virkning av TNF-alfa (20) – (22). Våre data bekrefter at etanercept er effektivt for revmatoid artritt-pasienter med behandlingsresistent sykdom (16). Etanercept gav en ACR-20-respons hos 70 % av pasientene etter tre måneder, men en ACR-20-respons angir i realiteten bare en beskjeden minsking av sykdomsaktiviteten hos disse dårlige pasientene. En ACR-50-respons betegner derimot en betydelig forbedring, og vi fant en ACR-50-responsrate på 30 – 50 % etter 12 måneder. Dette er sammenliknbart med resultatene i utprøvningssammenheng (16, 17).
Mens revmatoid artritt er hovedindikasjonen og hittil eneste godkjente indikasjon for behandling med etanercept, fant vi at pasienter med den polyartikulære form av psoriasisartritt og ankyloserende spondylitt hadde minst like god effekt av behandlingen. Antall pasienter var imidlertid relativt lavt, og dermed bør man være forsiktig med konklusjoner hos disse. Det er fortsatt uavklart om man bør kombinere etanercept med metotreksat for å oppnå høyere effektivitet siden effektiviteten av etanercept med eller uten ledsagende metotreksat behandling har vist seg å være nokså lik (23, 24). Vi fant heller ingen klar forskjell i responsen, men at metotreksat som tilleggsbehandling kunne reduserer risikoen for bivirkninger som leder til seponering. Det var signifikant høyere forekomst av kløende urtikarielt utslett hos pasienter som ikke brukte metotreksat ved oppstart (p < 0,05; data ikke vist). Etter at vi fant denne mulige sammenhengen, ble etanercept bare forskrevet i kombinasjon med et annet immunsupprimerende medikament (metotreksat eller imurel) i vår avdeling, og denne typen bivirkninger forekom ikke etter det.
Vi så for øvrig ingen tendens til økt forekomst av alvorlige infeksjoner blant våre pasienter, og de øvrige bivirkninger var relativt milde; dette tilsvarer andres funn (25). Etter evalueringstidspunktet fikk en av pasientene diagnostisert akutt myelogen leukemi, noe som ikke er rapporter tidligere. Det foreligger foreløpig ikke data internasjonalt som viser noen økt risiko for utvikling av malign sykdom ved anti-TNF-alfa-behandling.
Anti-TNF-alfa-medikamenter er såpass effektive i den klinisk hverdag, at denne behandlingsform synes å være det største fremskritt innenfor de revmatologiske behandlingsmuligheter siden introduksjonen av kortisonpreparatene for 50 år siden. Behandling er hittil blitt reservert for de dårligste pasientene, men man kan lett tenke seg mange andre tilstander med kronisk inflammasjon som også kan egne seg for denne type behandling. Nylig har flere studier dokumentert effekt av etanerceptbehandling ved juvenil kronisk polyartritt, ankyloserende spondylitt og psoriasisartritt (26) – (29). Kompliserte spondylartrittlidelser vil derved sannsynligvis være en viktig indikasjon for etanercept i fremtiden. Etanerceptbehandlingen er også blitt forsøkt hos pasienter med Crohns sykdom uten særlig effekt, og hos pasienter med Wegeners granulomatose med meget beskjeden effekt (30, 31).
Det er imidlertid flere usikre momenter som man også må ta hensyn til. Det handler i hovedsak om ukjente langtidsbivirkninger og økonomiske konsekvenser av denne kostbare behandling, særlig hvis indikasjonsområdene for disse medikamenter fortsetter å utvides og behandlingen skal fortsettes over lengre tid på linje med f.eks. insulinbehandling ved diabetes mellitus. I tillegg til risiko for utvikling av malign sykdom, er det risiko for utvikling av alvorlige infeksjoner, tuberkulose og demyeliniserende sykdom (32). Erfaringen med etanercept og tilsvarende medisiner er fremdeles kortvarig. Det finnes en studie med langtidsoppfølging hvor man fant at effekten holder seg over fem år uten at man kunne registrere flere nye bivirkninger (27). Selv om dette virker betryggende, bør man være oppmerksom på at observasjonstiden fortsatt er begrenset og at ukjente og alvorlige bivirkninger kan dukke opp etter lengre tids behandling. Det er derfor meget viktig at man følger disse pasienter nøye og helst i et regionalt eller nasjonalt register. Dette vil være den beste forsikring mot at vi senere vil komme til å oppleve ubehagelige overraskelser som f.eks. utvikling av cancer etter langtidsbehandling, i tråd med det som tidligere er påvist etter strålebehandling for ankyloserende spondylitt.
Kontinuerlig etanerceptbehandling koster ca. kr 150 000 per år per pasient. For dette får pasienten bedre livskvalitet med mye mindre smerter, lavere forbruk av smertestillende midler og forhåpentligvis også mindre fare for invalidisering. Samfunnet får en høy medikamentregning, men samtidig er forventningen at mange av disse pasienter skal kunne komme seg tilbake i arbeid, mens de ellers hadde gått langtidssykmeldt. En forutsetning er sannsynligvis at slik behandling blir satt inn på et relativt tidlig tidspunkt i sykdomsutviklingen.
Interessekonflikt
Gunnstein Bakland har mottatt kongresstøtte og Hans Nossent har mottatt reisetilskudd og honorar fra Wyeth Norge AS.
Interessekonflikter, se til slutt i artikkelen
- 1.
Riise T, Jacobsen BK, Gran JT. Incidence and prevalence of rheumatoid arthritis in the county of Troms, northern Norway. J Rheumatol 2000; 27: 1386 – 9.
- 2.
Uhlig T, Kvien TK, Glennas A, Smedstad LM, Forre O. The incidence and severity of rheumatoid arthritis, results from a county register in Oslo, Norway. J Rheumatol 1998; 25: 1078 – 84.
- 3.
Khan MA. Update on spondyloarthropathies. Ann Intern Med 2002; 136: 896 – 907.
- 4.
Zeidler HK, Kvien TK, Hannonen P, Wollheim FA, Forre O, Geidel H et al. Progression of joint damage in early active severe rheumatoid arthritis during 18 months of treatment: comparison of low-dose cyclosporin and parenteral gold. Br J Rheumatol 1998; 37: 874 – 82.
- 5.
Callahan LF, Pincus T. Mortality in the rheumatic diseases. Arthritis Care Res 1995; 8: 229 – 41.
- 6.
Pincus T, Brooks RH, Callahan LF. Prediction of long-term mortality in patients with rheumatoid arthritis according to simple questionnaire and joint count measures. Ann Intern Med 1994; 120: 26 – 34.
- 7.
Riise T, Jacobsen BK, Gran JT, Haga HJ, Arnesen E. Total mortality is increased in rheumatoid arthritis. A 17-year prospective study. Clin Rheumatol 2001; 20: 123 – 7.
- 8.
del Rincon ID, Williams K, Stern MP, Freeman GL, Escalante A. High incidence of cardiovascular events in a rheumatoid arthritis cohort not explained by traditional cardiac risk factors. Arthritis Rheum 2001; 44: 2737 – 45.
- 9.
Goodson N. Coronary artery disease and rheumatoid arthritis. Curr Opin Rheumatol 2002; 14: 115 – 20.
- 10.
Pincus T, Callahan LF. What is the natural history of rheumatoid arthritis? Rheum Dis Clin North Am 1993; 19: 123 – 51.
- 11.
Cope AP. Studies of T-cell activation in chronic inflammation. Arthritis Res 2002; 4 (suppl 3): 197 – 211.
- 12.
Chen G, Goeddel DV. TNF-R1 signalling: a beautiful pathway. Science 2002; 296: 1634 – 5.
- 13.
Jarvis B, Faulds D. Etanercept: a review of its use in rheumatoid arthritis. Drugs 1999; 57: 945 – 66.
- 14.
Balkwill F, Foxwell B, Brennan F. TNF is here to stay! Immunol Today 2000; 21: 470 – 1.
- 15.
Fautrel B, Cherin P. Value of anti-TNF-alfpha molecules in inflammatory and infectious diseases. Rev Med Interne 2000; 21: 872 – 88.
- 16.
Moreland LW, Schiff MH, Baumgartner SW, Tindall EA, Fleischmann RM, Bulpitt KJ et al. Etanercept therapy in rheumatoid arthritis. A randomized, controlled trial. Ann Intern Med 1999; 130: 478 – 86.
- 17.
Weinblatt ME, Kremer JM, Bankhurst AD, Bulpitt KJ, Fleischmann RM, Fox RI et al. A trial of etanercept, a recombinant tumor necrosis factor receptor: Fc fusion protein, in patients with rheumatoid arthritis receiving methotrexate. N Engl J Med 1999; 340: 253 – 9.
- 18.
Wolfe F. Which HAQ is best? A comparison of the HAQ, MHAQ and RA-HAQ, a difficult 8 item HAQ (DHAQ), and a rescored 20 item HAQ (HAQ20): analyses in 2,491 rheumatoid arthritis patients following leflunomide initiation. J Rheumatol 2001; 28: 982 – 9.
- 19.
Brekke M, Hjortdahl P, Kvien TK. Severity of musculoskeletal pain: relations to socioeconomic inequality. Soc Sci Med 2002; 54: 221 – 8.
- 20.
Hamilton K, Clair EW. Tumour necrosis factor-alpha blockade: a new era for effective management of rheumatoid arthritis. Expert Opin Pharmacother 2000; 1: 1041 – 52.
- 21.
Scallon B, Cai A, Solowski N, Song XY, Shealy D, Wagner C. Binding and functional comparisons of two types of tumor necrosis factor antagonists. J Pharmacol Exp Ther 2002; 301: 418 – 26.
- 22.
O’Dell JR. TNF-alpha inhibition: the need for a tumor necrosis factor thermostat. Mayo Clin Proc 2001; 76: 573 – 5.
- 23.
Genovese MC, Bathon JM, Martin RW , Fleischmann RM, Tesser JR, Schiff MH et al. Etanercept versus methotrexate in patients with early rheumatoid arthritis: Two-year radiographic and clinical outcomes. Arthritis Rheum 2002; 46: 1443 – 50.
- 24.
Moreland LW, Cohen SB, Baumgartner SW, Tindall EA, Bulpitt K, Martin R et al. Long-term safety and efficacy of etanercept in patients with rheumatoid arthritis. J Rheumatol 2001; 28: 1238 – 44.
- 25.
Phillips K, Husni ME, Karlson EW, Coblyn JS. Experience with etanercept in an academic medical center: are infection rates increased? Arthritis Rheum 2002; 47: 17 – 21.
- 26.
Yazici Y, Erkan D, Lockshin MD. Etanercept in the treatment of severe, resistant psoriatic arthritis: continued efficacy and changing patterns of use after two years. Clin Exp Rheumatol 2002; 20: 115.
- 27.
Gorman JD, Sack KE, Davis JC jr. Treatment of ankylosing spondylitis by inhibition of tumor necrosis factor alpha. N Engl J Med 2002; 346: 1349 – 56.
- 28.
Dayer JM, Krane SM. Anti-TNF-alpha therapy for ankylosing spondylitis – a specific or nonspecific treatment? N Engl J Med 2002; 346: 1399 – 400.
- 29.
Mease PJ. Tumour necrosis factor (TNF) in psoriatic arthritis: pathophysiology and treatment with TNF inhibitors. Ann Rheum Dis 2002; 61: 298 – 304.
- 30.
Sandborn WJ, Hanauer SB, Katz S, Safdi M, Wolf DG, Baerg RD et al. Etanercept for active Crohn’s disease: a randomized, double-blind, placebocontrolled trial. Gastroenterology 2001; 121: 1088 – 94.
- 31.
Stone JH, Uhlfelder ML, Hellmann DB, Crook S, Bedocs NM, Hoffman GS. Etanercept combined with conventional treatment in Wegener’s granulomatosis: a six-month open-label trial to evaluate safety. Arthritis Rheum 2001; 44: 1149 – 54.
- 32.
Mohan N, Edwards ET, Cupps TR, Oliverio PJ, Sandberg G, Crayton H et al. Demyelination occurring during anti-tumor necrosis factor alpha therapy for inflammatory arthritides. Arthritis Rheum 2001; 44: 2862 – 9.