Basert på tidligere publiserte/aksepterte originalarbeider (20, 21, 39, 40)
Kreft i munnhulen (fremre to tredeler av tunge, munnhulens gulv, harde gane, tannkjøtt og kinnslimhinne) rammer om lag 250 personer årlig i Norge, og forekomsten øker, også i yngre aldersgrupper (1). Til tross for omfattende forskning for å forbedre behandling av pasienter med kreft i hode- og halsområdet er femårs overlevelsesrate for denne pasientgruppen ikke vesentlig bedret de siste 50 årene (1 – 6). Tidligere diagnostikk og behandling er et av de få aktuelle alternativene for å redusere sykelighet og dødelighet av denne kreftformen.
De dominerende risikofaktorene for munnhulekreft er tobakk og alkohol. De fleste som har utviklet plateepitelkarsinomer i munnhulen, har vært eksponert for en eller begge risikofaktorer (7). Likevel er det bare en liten del av personer med slik risikoatferd som får plateepitelkarsinomer i hode- og halsområdet (8, 9). Fordi man ikke har hatt gode nok metoder til å identifisere pasienter med særlig høy risiko for utvikling av kreft fra premaligne lesjoner har man valgt å observere disse pasientene og behandle aktivt med kirurgi og strålebehandling kun de pasienter som har fått manifeste karsinomer. Ofte er dette for sent, fordi pasientene presenterer seg med avanserte (stadium 3 – 4) lesjoner (5, 10). Femårsoverlevelsen av selv begrenset sykdom (stadium 1 – 2) er i enkelte undersøkelser angitt å være så lav som 50 % (11).
Så å si alle plateepitelkarsinomer i munnhulen er forutgått av lett synlige hvite eller røde flekker i munnslimhinnen, noe som gir muligheten til identifisere og behandle lesjoner før de har utviklet seg til karsinomer (12 – 15). 5 – 15 % av hvite flekker i munnhulen og opptil 90 % av de røde flekkene vil utvikles til kreft (16 – 19). Det er derfor grunn til å være oppmerksom på det maligne potensialet til disse lesjonene. Effektiv forebyggende behandling har vært vanskelig å gi, fordi man ikke har hatt noen gode metoder til å identifisere de pasienter som har særlig høy risiko for utvikling av kreft fra hvite flekker. Vi har nylig undersøkt den prognostiske verdien av å identifisere DNA-innhold og grove genomiske avvik (DNA-aneuploiditet) i epitelceller fra hvite (leukoplakier) og røde (erytroplakier) flekker i munnhulen (20, 21). Felles for alle pasientene inkludert i disse undersøkelsene har vært at de ikke har hatt samtidig eller forutgående kreft, verken i hode- og halsområdet eller i andre lokalisasjoner. Alle pasienten hadde lesjoner som var blitt undersøkt histologisk, og ingen av pasientene hadde karsinomer eller carcinoma in situ. I denne oversiktsartikkelen presenterer vi et sammendrag av prognostiske undersøkelser hos pasienter med røde og hvite slimhinneforandringer i munnhulen, og diskuterer mulige behandlingsalternativer for pasienter med munnhulelesjoner som med stor sannsynlighet vil utvikles til kreft.
Grove genomiske avvik
Omfattende vitenskapelig dokumentasjon peker nå mot grove genomiske avvik (DNA-aneuploiditet) som en årsak til, snarere enn en konsekvens av kreftutvikling (22 – 24), også for kreft i hode- og halsområdet (25 – 27). Det molekylærbiologiske substratet for DNA-aneuploiditet er oftest ubalansert fordeling av kromosomer til datterceller. Dette kan igjen skyldes geniske mutasjoner (punktmutasjoner) i gener som koder for proteiner som styrer mitosen er vist å gi aneuploiditet (28). Andre strukturforandringer i genomet som kan gi DNA-aneuploiditet er kromosomale mutasjoner (for eksempel delesjoner, translokasjoner eller amplifikasjoner) eller genomiske mutasjoner (forandringer og avvik i antall kromosomer). Slike forandringer kan i sin tur kan føre til nye geniske, kromosomale eller genomiske mutasjoner. Resultatet kan bli endret metabolisme i cellene med neoplastisk vekst som følge (29, 30). Grove genomiske avvik er ofte tidlig forekommende i forløpet av en malign transformasjon (31) og kan derfor være en tidlig markør for kreftutvikling (32).
Metode for analyse av grove genomiske avvik (DNA-ploiditetsanalyse)
Parafininnstøpte blokker med vevsbiter ble snittet i tykke snitt (50 µ m) før enzymatisk bearbeiding (type XXIV-protease, Sigma Chemical, St. Louis) for fremstilling av isolerte cellekjerner. Hematoksylin- og eosinfargede snitt ble fremstilt før og etter snitting av tykke snitt for å få bekreftet innholdet av dysplastisk materiale i de tykke snittene.
DNA-innhold i cellekjerner ble målt ved transmisjonsmikroskopi av Feulgen-Schiff-fargede cellekjerner (33), med Fairfield bildeanalysesystem (Fairfield Imaging Systems, Tunbridge Wells, Storbritannia). Fortolkningene av DNA-ploiditets-distribusjonshistogrammer ble foretatt i henhold til en etablert protokoll (34). Fremstilling av isolerte cellekjerner fulgte en standardisert prosedyre, etablert ved Det Norske Radiumhospital (fig 1) (33, 35).
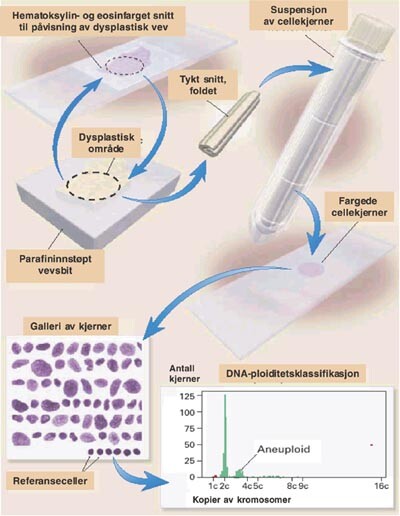
Grupper av analyserte munnhulelesjoner
Leukoplakier med innhold av dysplasi
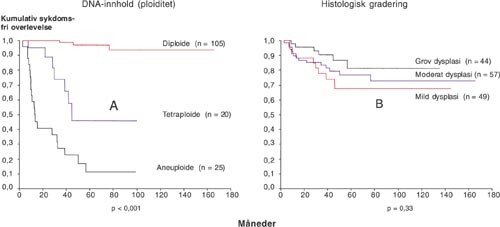
Vi identifiserte 242 pasienter med orale leukoplakier, hvorav biopsier fra 196 pasienter var blitt histologisk klassifisert som dysplastiske. Diagnosen dysplasi ble bekreftet av fire uavhengige patologer, som i tillegg graderte dysplasiene histologisk i henhold til retningslinjer gitt av WHO (36, 37). Lesjoner fra 150 av de 196 pasientene var tilgjengelige for måling av DNA-ploiditet. Eksempler på DNA-dysplastiske biopsier og de korresponderende DNA-ploiditets-distribusjonshistogrammer er vist i figur 2. Ved sammenlikning av DNA-ploiditetsklassifikasjon og den tradisjonelt anvendte histologisk gradering som prognostisk verktøy, fant man at DNA-ploiditetsklassifikasjon hadde betydelig prognostisk verdi (fig 3a), mens den histologiske graderingen ikke hadde statistisk signifikant verdi (fig 3b) (20).
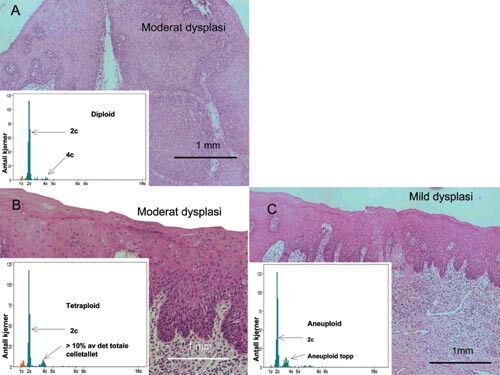
Leukoplakier uten innhold av dysplasi
Hos 46 pasienter forelå det biopsier som opprinnelig var blitt klassifisert som dysplastiske, men som ved etterprøving av diagnosen ble funnet å være ikke-dysplastiske (akantose, hyperplasi, kronisk inflammasjon, lichen ruber planus) (21). Hos en pasient var det uenighet om hvilket organ lesjonen kom fra, og denne pasienten ble derfor utelatt fra analysen.
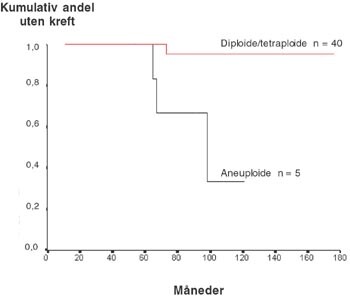
Fem av de gjenværende 45 pasientene, som i utgangspunktet hadde lesjoner man ikke ville mistenkt for å være premaligne, hadde DNA-aneuploide lesjoner. Fire av de fem pasientene med DNA-aneuploide lesjoner utviklet et plateepitelkarsinom i munnhulen i løpet av observasjonstiden (fig 4). Kun en av 40 pasienter med euploide lesjoner utviklet kreft i løpet av observasjonstiden.
I sum viser disse to undersøkelsene at grove genomiske avvik kan brukes til å forutsi forekomsten av plateepitelkarsinomer i munnhulen med stor grad av sikkerhet, uavhengig av hvilken histologisk diagnose disse pasientene har fått. DNA-ploiditet samsvarer ikke med histologisk gradering av dysplasier, og slik gradering har meget begrenset prognostisk verdi (20, 38, 39). I tillegg viser våre undersøkelser at grove genomiske avvik kan brukes til å identifisere pasienter med høy risiko blant pasienter som ellers ikke ville blitt mistenkt for å ha lesjoner som representerte forstadier til kreft. Konklusjonen etter disse studiene er derfor at grove genomiske avvik (DNA-aneuploiditet) som eneste prognostiske markør kan brukes til å forutsi det kliniske forløpet i alle typer hvite flekker som oppstår i munnhulen.
Erytroplakier med innhold av dysplasi
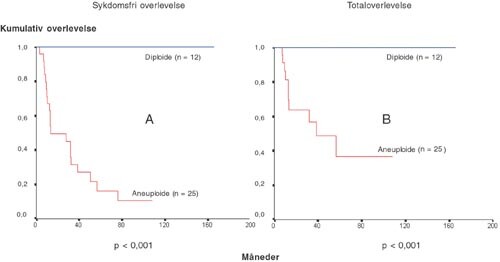
Røde flekker i munnslimhinnen har en langt mer uttalt tendens til malign transformasjon enn hvite flekker, men forekommer sjeldnere (18). I enkelte studier angis den maligne transformasjonsraten å ligge på 90 % (18, 19). Det er derfor sjelden at man finner pasienter med røde flekker som histologisk viser seg å være premaligne lesjoner. Vi har identifisert 37 slike pasienter, og undersøkt 57 biopsier fra disse med hensyn til DNA-ploiditetsstatus. 25 (67 %) pasienter hadde DNA aneuploide lesjoner. I løpet av en observasjonsperiode på om lag sju år utviklet 23 (92 %) av disse pasientene et munnhulekarsinom (40). Ingen av pasientene med DNA-diploide (normale lesjoner) utviklet karsinom i løpet av observasjonsperioden (fig 5).
Behandlingsalternativer
Munnhulen kan tjene som et modellsystem for studier på kjemoprevensjon, fordi premaligne lesjoner her lett kan identifiseres og følges opp. Slike lesjoner er dessuten forbundet med forekomst av karsinomer i andre avsnitt av øvre aerodigestive kanal. Til tross for den opplagte muligheten man har hatt til å identifisere munnhulekarsinomer på et tidlig stadium, er langtidsoverlevelsen dårlig, og forekomsten øker, spesielt i yngre aldersgrupper. Årsakene til dette kjenner man ikke fullt ut, men det foreligger store geografiske forskjeller, også i den vestlige verden. Økningen i insidens er spesielt stor sør og øst i Europa.
Den kliniske verdien i tidlig kartlegging av orale leukoplakiers maligne potensial skyldes at det i dag finnes mulige behandlingstiltak. De mest opplagte mulighetene er fotodynamisk terapi i kombinasjon med aminolevulinsyre, samt behandling med en COX-2-hemmer.
Kjemoprevensjon
Medikamentell behandling av premaligne lidelser i munnhulen er gjennomført i flere studier (41 – 47), men den kliniske effekten er diskutabel av to årsaker (48, 49): bivirkningsprofilen til retinoider, som har vært mest brukt, og mangel på faktorer som sikkert identifiserer høyrisikogrupper (36). Slik medikamentell forebyggende behandling forutsetter dessuten at man med stor sensitivitet og spesifisitet kan identifisere pasienter som i særlig grad er utsatt for å få kreft. Høyrisikoindivider vil kunne identifiseres ved å kartlegge DNA-innhold i leukoplakier og randomisere pasienter med DNA-aneuploide og -tetraploide lesjoner til ulike behandlingsgrener, fordi man ved hjelp av disse analysemetodene finner frem til høyrisikopasientene. I tillegg har metodene stor spesifisitet; pasienter med DNA-diploide lesjoner kan man med stor grad av sikkerhet (97 % sikkerhet) la være å behandle. Disse analysemetodene er derfor velegnet som verktøy for opportunistisk screening.
Nyere medikamenter med langt gunstigere bivirkningsprofil og sannsynlig effekt på orale premaligne tilstander er nå tilgjengelige (50 – 53) og vil kunne brukes i en randomisert studie hos pasienter med premaligne lesjoner i munnhulen.
Epidemiologiske studier antyder at ikke-steroide antiinflammatoriske midler reduserer risikoen for å få kolorektalkreft, delvis ved hemming av prostaglandinsyntesen. Cyklooksygenase, som er det hastighetsbestemmende enzymet i prostaglandinsyntesen, finnes i to isoformer, cyklooksygenase 1 og 2 (COX-1 og COX-2). Genetiske og farmakologiske studier viser at COX-2 sannsynligvis er av betydning for utvikling av flere kreftformer.
Celecoxib, som induserer apoptose ved selektivt å hemme enzymet cyklooksygenase-2 (COX-2) er nylig i en randomisert studie vist å ha en reduserende effekt på størrelsen og antallet kolorektale polypper i høyrisikoindivider, med familiær adenomatøs polypose. I disse lesjonene vises regelmessig en økt ekspresjon av COX-2 og dette danner grunnlaget for bruk av celecoxib. Vi har i en foreløpig upublisert studie vist at COX-2-ekspresjonen er økt i premaligne og maligne lesjoner i munnhulen, sammenliknet med normal munnslimhinne. Dette gir en antydning om at disse medikamentene også kan brukes som kreftforebyggende medikamenter hos høyrisikopasienter med munnhulekreft.
Lokalbehandling med lys (fotodynamisk terapi)
Fotodynamisk terapi er en behandlingsform som er basert på at et fotosensitiviserende substans i kombinasjon med belysning av en bestemt bølgelengde, gir en selektiv celle- og vevsskade i de områder man ønsker å behandle. Behandlingsformen er ikke ny (54), men har tidligere ikke blitt brukt i stor utstrekning på orale premaligne lesjoner.
5-aminolevulinsyre (ALA) inngår i den mitokondrielle syntesen av hem fra protoporfyrin IX (PpIX), og syntesen av PpIX er et hastighetsbestemmende trinn i denne prosessen. Det er vist at intracellulær PpIX hoper seg opp i epiteliale celler når de er blitt eksponert for ALA. PpIX kan aktiveres av lys i bestemte bølgelengder, med celleskade til følge. Celledøden skyldes først og fremst mitokondriell skade.
Metylesteren til ALA, metyl 5-aminolevulinate (Metvix, Photocure, Oslo) er for tiden under utprøvning ved Det Norske Radiumhospital, hos pasienter med basalcellekarsinom, og en studie på munnhulelesjoner er planlagt. Farmakokinetiske studier har vist at det foreligger et selektivt opptak i slimhinneområder hvor det foreligger patologiske forandringer, som lichen ruber planus. ALAs selektive opptak til patologisk endret vev gjør den spesielt egnet som sensitiviseringssubstans før lysbehandling av premaligne lesjoner.
Diskusjon
Måling av DNA-innhold synes å være langt overlegen andre tilgjengelige undersøkelsesmetoder for å forutsi det kliniske utfallet hos pasienter med dysplastiske hvite flekker på et tidlig tidspunkt. En kartlegging av grove genomisk avvik har også en høy prognostisk verdi hos pasienter med erytroplakier i munnhulen. Bestemmelse av DNA-ploiditet er derfor en prognostisk markør i et vidt spekter av biologisk svært ulike lesjoner. Det kan derfor tenkes at metodene kan brukes til prognostisk kartlegging av premaligne lesjoner også i andre overflatevev. Våre data viser at det er mulig, med stor grad av sikkerhet, å identifisere pasienter med munnhulelesjoner som vil gi opphav til kreft. Det finnes i dag muligheter til å intervenere mot slike forstadier til kreft, i en pasientgruppe som ellers først kommer til behandling i langtkomne stadier av sin kreftsykdom. Pasienter med DNA-aneuploide og tetraploide dysplasier bør derfor få et tilbud om behandling. I Norge blir alle dysplastiske orale leukoplakier innrapportert til Kreftregisteret, og disse pasientene kan derfor lett identifiseres og inviteres til en undersøkelse og eventuelle behandling. I tillegg vil personer med høyrisikoatferd (røyking, stort alkoholforbruk) kunne identifiseres gjennom data innsamlet fra Statens helseundersøkelser. Blant disse kan man finne frem til personer med DNA-aneuploide lesjoner og tilby behandling før invasiv kreft utvikles. Det er gitt tilsagn fra Sosial- og helsedepartmentet om at analyse av DNA-innhold i cellekjerner i munnslimhinneforandringer hos pasienter med høyrisikoatferd er en undersøkelse som vil dekkes over trygdebudsjettet.
T. Warloe er patentinnehaver for patentet som benyttes kommersielt av PhotoCure ASA. Det Norske Radiumhospital har aksjer i PhotoCure ASA.
- 1.
Cancer in Norway 1996. Oslo: The Cancer Registry of Norway. Institute for epidemiological cancer research, 2000.
- 2.
Boyle P, Macfarlane GJ, Scully C. Oral cancer: necessity for prevention strategies. Lancet 1993; 342: 1129.
- 3.
Macfarlane GJ, Boyle P, Evstifeeva TV, Robertson C, Scully C. Rising trends of oral cancer mortality among males worldwide: the return of an old public health problem. Cancer Causes Control 1994; 5: 259 – 65.
- 4.
Macfarlane GJ, Evstifeeva TV, Robertson C, Boyle P, Scully C. Trends of oral cancer mortality among females worldwide. Cancer Causes Control 1994; 5: 255 – 8.
- 5.
Stell PM, McCormick MS. Cancer of the head and neck: are we doing any better? Lancet 1985; 2: 1127.
- 6.
Mork J. Forty years of monitoring head and neck cancer in Norway – no good news. Anticancer Res 1998; 18: 3705 – 8.
- 7.
Schantz SP. Basic science advances in head and neck oncology: the past decade. Semin Surg Oncol 1995; 11: 272 – 9.
- 8.
Schantz SP, Zhang ZF, Spitz MS, Sun M, Hsu TC. Genetic susceptibility to head and neck cancer: interaction between nutrition and mutagen sensitivity. Laryngoscope 1997; 107: 765 – 81.
- 9.
Schantz SP, Huang Q, Shah K, Murty VV, Hsu TC, Yu G et al. Mutagen sensitivity and environmental exposures as contributing causes of chromosome 3p losses in head and neck cancers. Carcinogenesis 2000; 21: 1239 – 46.
- 10.
Ellison MD, Campbell BH. Screening for cancers of the head and neck: addressing the problem. Surg Oncol Clin N Am 1999; 8: 725 – 34.
- 11.
Sellars SL. Epidemiology of oral cancer. Otolaryngol Clin North Am 1979; 12: 45 – 55.
- 12.
Waldron CA, Shafer WG. Leukoplakia revisited. A clinicopathologic study 3256 oral leukoplakias. Cancer 1975; 36: 1386 – 92.
- 13.
Gupta PC. Leukoplakia and incidence of oral cancer. J Oral Pathol Med 1989; 18: 17.
- 14.
Mashberg A, Garfinkel L. Early diagnosis of oral cancer: the erythroplastic lesion in high risk sites. CA Cancer J Clin 1978; 28: 297 – 303.
- 15.
Mashberg A. Erythroplasia: the earliest sign of asymptomatic oral cancer. J Am Dent Assoc 1978; 96: 615 – 20.
- 16.
Mao L. Leukoplakia: molecular understanding of pre-malignant lesions and implications for clinical management. Mol Med Today 1997; 3: 442 – 8.
- 17.
Ephros H, Samit A. Leukoplakia and malignant transformation. Oral Surg Oral Med Oral Pathol 1997; 83: 187.
- 18.
Bouquot JE, Ephros H. Erythroplakia: the dangerous red mucosa. Pract Periodontics Aesthet Dent 1995; 7: 59 – 67.
- 19.
Bouquot JE. Oral leukoplakia and erythroplakia: a review and update. Pract Periodontics Aesthet Dent 1994; 6: 9 – 17.
- 20.
Sudbø J, Kildal W, Risberg B, Koppang HS, Danielsen HE, Reith A. DNA content as a prognostic marker in patients with oral leukoplakias. N Engl J Med 2001; 344: 1270 – 8.
- 21.
Sudbø J, Ried T, Bryne M, Kildal W, Danielsen HE, Reith A. Abnormal DNA content predicts the occurence of carcinomas in non-dysplastic oral white patches. Oral Oncol 2001; 37: 11 – 8.
- 22.
Shih IM, Zhou W, Goodman SN, Lengauer C, Kinzler KW, Vogelstein B. Evidence that genetic instability occurs at an early stage of colorectal tumorigenesis. Cancer Res 2001; 61: 818 – 22.
- 23.
Duesberg P, Rasnick D. Aneuploidy, the somatic mutation that makes cancer a species of its own. Cell Motil Cytoskeleton 2000; 47: 81 – 107.
- 24.
Duesberg P, Li R, Rasnick D, Rausch C, Willer A, Kraemer A et al. Aneuploidy precedes and segregates with chemical carcinogenesis. Cancer Genet Cytogenet 2000; 119: 83 – 93.
- 25.
Scully C, Field JK, Tanzawa H. Genetic aberrations in oral or head and neck squamous cell carcinoma 3: clinico-pathological application Oral Oncol 2000; 36: 404 – 13.
- 26.
Scully C, Field JK, Tanzawa H. Genetic aberrations in oral or head and neck squamous cell carcinoma 2: chromosomal aberrations. Oral Oncol 2000; 36: 311 – 27.
- 27.
Scully C, Field JK, Tanzawa H. Genetic aberrations in oral or head and neck squamous cell carcinoma (SCCHN): 1. Carcinogen metabolism, DNA repair and cell cycle control. Oral Oncol 2000; 36: 256 – 63.
- 28.
Michel LS, Liberal V, Chatterjee A, Kirchwegger R, Pasche B, Gerald W, et al. MAD2 haplo-insufficiency causes premature anaphase and chromosome instability in mammalian cells. Nature 2001; 409: 355 – 9.
- 29.
Duesberg P, Rasnick D, Li R, Winters L, Rausch C, Hehlmann R. How aneuploidy may cause cancer and genetic instability. Anticancer Res 1999; 19: 4887 – 906.
- 30.
Rasnick D, Duesberg PH. How aneuploidy affects metabolic control and causes cancer. Biochem J 1999; 340: 621 – 30.
- 31.
Ghadimi BM, Sackett DL, Difilippantonio MJ, Schrock E, Neumann T, Jauho A et al. Centrosome amplification and instability occurs exclusively in aneuploid, but not in diploid colorectal cancer cell lines, and correlates with numerical chromosomal aberrations. Genes Chromosomes Cancer 2000; 27: 183 – 90.
- 32.
Sen S. Aneuploidy and cancer. Curr Opin Oncol 2000; 12: 82 – 8.
- 33.
Hedley DW. DNA analysis from paraffin-embedded blocks. Methods Cell Biol 1994; 41: 231 – 40.
- 34.
Haroske G, Giroud F, Reith A, Bocking A. 1997 ESACP consensus report on diagnostic DNA image cytometry. Part I: basic considerations and recommendations for preparation, measurement and interpretation. European Society for Analytical Cellular Pathology. Anal Cell Pathol 1998; 17: 189 – 200.
- 35.
Hedley DW, Shankey TV, Wheeless LL. DNA cytometry consensus conference. Cytometry 1993; 14: 471.
- 36.
Lee JJ, Hong WK, Hittelman WN, Mao L, Lotan R, Shin DM et al. Predicting cancer development in oral leukoplakia: ten years of translational research. Clin Cancer Res 2000; 6: 1702 – 10.
- 37.
Pindborg JJ, Reichart PA and Smith CJ, red. Histological typing of cancer and precancer of the oral mucosa. 2. utg. London: Springer, 1997.
- 38.
Karabulut A, Reibel J, Therkildsen MH, Praetorius F, Nielsen HW, Dabelsteen E. Observer variability in the histologic assessment of oral premalignant lesions. J Oral Pathol Med 1995; 24: 198 – 200.
- 39.
Sudbø J, Bryne M, Johannessen AC, Kildal W, Reith A, Danielsen HE. Comparison of histological grading and large scale genomic status (DNA ploidy) as prognostic tools in oral dysplasia. J Pathol 2001; 194: 303 – 10.
- 40.
Sudbø J, Kildal W, Johannessen AC, Koppang HS, Sudbø A, Danielsen HE et al. Gross genomic aberrations in precancers: clinical implications of a long-term follow-up study in oral erythroplakias. J Clin Oncol 2001; akseptert for publisering.
- 41.
Hong WK, Endicott J, Itri LM, Doos W, Batsakis JG, Bell R et al. 13-cis-retinoic acid in the treatment of oral leukoplakia. N Engl J Med 1986; 315: 1501 – 5.
- 42.
Lippman SM, Batsakis JG, Toth BB, Weber RS, Lee JJ, Martin JW et al. Comparison of low-dose isotretinoin with beta carotene to prevent oral carcinogenesis. N Engl J Med 1993; 328: 15 – 20.
- 43.
Lippman SM, Heyman RA, Kurie JM, Benner SE, Hong WK. Retinoids and chemoprevention: clinical and basic studies. J Cell Biochem Suppl 1995; 22: 1 – 10.
- 44.
Lotan R, Xu XC, Lippman SM, Ro JY, Lee JS, Lee JJ et al. Suppression of retinoic acid receptor-beta in premalignant oral lesions and its up-regulation by isotretinoin. N Engl J Med 1995; 332: 1405 – 10.
- 45.
Voravud N. Chemoprevention of head and neck cancer. J Med Assoc Thai 1996; 79: 185 – 93.
- 46.
Sporn MB. The war on cancer: a review. Ann N Y Acad Sci 1997; 833: 137 – 46.
- 47.
Kelloff GJ, Crowell JA, Steele VE, Lubet RA, Boone CW, Malone WA et al. Progress in cancer chemoprevention. Ann N Y Acad Sci 1999; 889: 1 – 13.
- 48.
Boyle P, Chiesa F, Scully C. Chemoprevention and oral cancer – (more) trials and (more) tribulations. Eur J Cancer B Oral Oncol 1995; 31B: 1 – 2.
- 49.
Hindle I, Downer MC, Speight PM. Necessity for prevention strategies in oral cancer. Lancet 1994; 343: 178 – 9.
- 50.
Ristimaki A, Nieminen O, Saukkonen K, Hotakainen K, Nordling S, Haglund C. Expression of cyclooxygenase-2 in human transitional cell carcinoma of the urinary bladder. Am J Pathol 2001; 158: 849 – 53.
- 51.
Erkinheimo TL, Saukkonen K, Narko K, Jalkanen J, Ylikorkala O, Ristimaki A. Expression of cyclooxygenase-2 and prostanoid receptors by human myometrium. J Clin Endocrinol Metab 2000; 85: 3468 – 75.
- 52.
Wolff H, Saukkonen K, Anttila S, Karjalainen A, Vainio H, Ristimaki A. Expression of cyclooxygenase-2 in human lung carcinoma. Cancer Res 1998; 58: 4997 – 5001.
- 53.
Steinbach G, Lynch PM, Phillips RK, Wallace MH, Hawk E, Gordon GB et al. The effect of celecoxib, a cyclooxygenase-2 inhibitor, in familial adenomatous polyposis. N Engl J Med 2000; 342: 1946 – 52.
- 54.
Dougherty TJ. Photodynamic therapy (PDT) of malignant tumors. Crit Rev Oncol Hematol 1984; 2: 83 – 116.