Behandling av eldre med akutt myelogen leukemi uten allogen stamcelletransplantasjon ved Akershus universitetssykehus
BACKGROUND
It is uncertain what the best treatment is for older patients with acute myeloid leukaemia who are not candidates for allogeneic stem cell transplantation. The purpose of the study was to examine the treatment practices for this patient group at Akershus University Hospital, as well as survival according to treatment choices and the genetic risk of a tumour.
MATERIAL AND METHOD
The study is based on a review of the medical records of patients aged 65 and older with recently diagnosed acute myeloid leukaemia treated without allogeneic stem cell transplantation at Akershus University Hospital from 1 January 2006 to 1 January 2021.
RESULTS
We included 151 out of 156 identified patients. The median age was 76 years, 42 patients (28 %) received intensive chemotherapy, 38 (25 %) received low-intensity chemotherapy and 71 (47 %) received supportive care only. Supportive care was mainly given in the early part of the period. From 2014 onwards, low-intensity chemotherapy made up a significant part of the treatment. Tumour genetic analyses were available for 88 patients, of which 17, 47 and 24 had a favourable, intermediate and unfavourable genetic risk of a tumour respectively. None of the patients with an unfavourable genetic risk of a tumour survived for 2 years. There were no statistically significant differences in survival between low-intensity and intensive chemotherapy. In the group with a favourable genetic risk of a tumour, the median survival was 573 days with intensive chemotherapy (n=12) and 101 days with low-intensity chemotherapy (n=4) (p=0.09). Patients treated with intensive chemotherapy were in hospital the longest.
INTERPRETATION
The results suggest that knowledge of the genetic risk of a tumour is useful when choosing treatment for older patients with acute myeloid leukaemia.
HOVEDFUNN
Behandlingen av eldre pasienter med akutt myelogen leukemi som ikke var kandidater for allogen stamcelletransplantasjon, endret seg i perioden 2006–21 fra hovedsakelig støttende behandling til mer intensiv og lavintensiv kjemoterapibehandling.
Det var ingen statistisk signifikant forskjell i overlevelse mellom pasienter behandlet med intensiv kjemoterapi og lavintensiv kjemoterapi.
Alle med ugunstig tumorgenetisk risiko døde innen to år uansett behandling.
Pasienter som fikk intensiv kjemoterapi, hadde flest dager innlagt på sykehus.
Det er omtrent 150–200 nye tilfeller med akutt myelogen leukemi i Norge i året (personlig meddelelse fra Kreftregisteret og (1)). Vi kjenner ikke median alder ved diagnosetidspunktet i Norge, men den er estimert til 72 år i Sverige og 68 år i USA (2, 3). Eldre har dårligere prognose enn yngre pasienter, blant annet fordi det er høyere forekomst av ugunstige genetiske forandringer i kreftcellene, noe som igjen gir økt resistens for kjemoterapi (4). Samtidig gjør dårligere funksjonsstatus og komorbiditet pasientene mer utsatt for behandlingsrelatert død. Behandling av eldre med akutt myelogen leukemi er derfor utfordrende, og ofte må man ha en individuell tilnærming. Denne gruppen tilbys ofte lavintensiv kjemoterapi (5).
Den vanligste kurative behandlingen av akutt myelogen leukemi er intensiv kjemoterapi. De fleste må også ha konsoliderende behandling med allogen stamcelletransplantasjon (5). Eldre blir vanligvis ikke tilbudt allogen stamcelletransplantasjon, fordi toksisiteten og den behandlingsrelaterte mortaliteten regnes som for høy (6). I stedet gis ofte lavintensiv kjemoterapi med for eksempel hypometylerende behandling eller lavdosert cytarabin (5). Imidlertid viste en svensk registerstudie fra 2009 at intensiv kjemoterapi var assosiert med lenger overlevelse enn lavintensiv kjemoterapi hos eldre med akutt myelogen leukemi og at pasienter opp mot 80 år trolig kunne dra fordel av slik behandling (2). En nyere observasjonsstudie fra Florida i USA viste derimot en overlevelsesfordel for pasienter behandlet med hypometylerende agens sammenliknet med intensiv kjemoterapi (7). I andre observasjonsstudier er det funnet tilsvarende motsigende resultater (8–10). Det er altså uklart om eldre pasienter som ikke er kandidater for allogen stamcelletransplantasjon, er best tjent med intensiv kjemoterapi eller med lavintensive kjemoterapiregimer.
Leukemicellenes genetiske forandringer er viktige prognostiske markører. Ulike prognoseverktøy basert på genetiske forandringer i kreftcellene er etablert for å kategorisere risikoen for død (tumorgenetisk risiko) hos pasienter med akutt myelogen leukemi. Disse verktøyene er obligatoriske i vurderingen av yngre pasienter med akutt myelogen leukemi, men eldre pasienter har ikke rutinemessig blitt vurdert med slike verktøy. Kategoriseringsverktøyet brukt i Norge de siste årene er laget av European LeukemiaNet (11).
I denne artikkelen ønsket vi å studere behandlingspraksis ved Akershus universitetssykehus samt overlevelse etter behandlingsvalg og tumorgenetisk risiko hos pasienter 65 år eller eldre med akutt myelogen leukemi som ikke var kandidat for allogen stamcelletransplantasjon.
Materiale og metode
Vi har gjennomgått journaldata til eldre pasienter som ble behandlet for akutt myelogen leukemi ved Akershus universitetssykehus i tidsrommet 1.1.2006–1.1.2021 og som ikke var kandidater for allogen stamcelletransplantasjon. Inklusjonskriteriene var alder 65 år eller eldre og at pasientene hadde nydiagnostisert, ubehandlet (før presentasjon ved sykehuset) akutt myelogen leukemi definert av ICD-10-kodene C92.0, C92.5, C92.6, C92.7, C92.8 og C92.9, C93.0, C93.7, C93.9, C94.0, C94.2, C94.7, C95.0, C95.7 og C95.9. Aktuelle pasienter ble identifisert via søk på diagnosekodene i journalsystemet. Pasienter med andre forutgående hematologiske sykdommer ble inkludert uavhengig av tidligere behandling.
Variablene som ble hentet fra journalene, inkluderte kjønn, alder ved diagnose, førstelinjebehandling, ev. dødsdato, forutgående hematologiske sykdommer, cytogenetikk, molekylær patologi og totalt antall dager innlagt i sykehus innen to år fra diagnosen ble satt. En innlagt dag i sykehus ble definert som at pasienten lå natten igjennom på sykehus.
Pasientene ble kategorisert i tre ulike behandlingsgrupper: «intensiv kjemoterapi» (definert som behandlinger som gir benmargsaplasi), «lavintensiv kjemoterapi» (definert som azacitidin, decitabin eller lavdose cytarabin) og «støttende behandling» (definert som kun støttende behandling eller behandling med hydroksyurea). Fem pasienter fikk en sjelden type behandling som ikke passet inn i noen av disse kategoriene. Disse ble ekskludert fra videre analyser.
Vi benyttet European LeukemiaNet sin risikostratifisering fra 2017. Pasientene ble kategorisert i gunstig, intermediær og ugunstig risikogruppe ut fra kromosomale avvik og mutasjoner i visse gener i kreftcellene der denne informasjonen var tilgjengelig (n = 88). Disse avvikene er assosiert med overlevelse hos pasientene med akutt myelogen leukemi (11). For fire pasienter var det ikke tilgjengelig genetiske data til å klassifisere i henhold til 2017-risikostratifiseringen, disse ble derfor klassifisert etter risikostratifiseringen fra 2010 (12). For 63 pasienter forelå det ikke data som gjorde det mulig å risikostratifisere. Respons på behandling i gruppen som fikk intensiv kjemoterapi, ble også gjort etter European LeukemiaNets klassifisering fra 2017.
Statistiske analyser
Overlevelse ble definert som dager fra diagnosedato til dødsdato eller fra diagnosedato til studieslutt 1.1.2021. Overlevelse ble analysert med Kaplan-Meier-kurver og log-rank-test. Median overlevelse ble beregnet ut fra Kaplan-Meier-kurvene. Pasienter som fortsatt var i live ved studieslutt 1.1.2021, ble sensurert. Andelen dager innlagt i sykehus ble beregnet som antall dager innlagt dividert med antall dager man hadde overlevd innenfor to år etter diagnose, og ble angitt i prosent. Pasienter som fikk akutt myelogen leukemi etter 1.1.2019 og som fremdeles var i live 1.1.2021, ble utelatt fra denne analysen. Statistiske analyser ble utført ved bruk av IBM SPSS Statistics Data Editor.
Etiske overveielser
Studien ble godkjent av personvernombudet ved Akershus universitetssykehus. Vi vurderte studien til å falle utenfor helseforskningsloven og at det dermed ikke var behov for godkjenning hos regional komité for medisinsk og helsefaglig forskningsetikk.
Resultater
Vi identifiserte 156 pasienter ≥ 65 år med akutt myelogen leukemi som ikke fikk allogen stamcelletransplantasjon. Tabell 1 viser valg av førstelinjebehandling hos pasientene. Flest pasienter (n = 71) fikk kun støttende behandling, 42 fikk intensiv kjemoterapi og 38 fikk standard lavintensiv kjemoterapi. De fem pasientene som fikk «annen lavintensiv kjemoterapi» ble ekskludert fra videre analyser. Av de 42 pasientene som fikk intensiv kjemoterapi, kunne vi gjøre en vurdering av behandlingseffekt hos 39. Av de 39 var det 28 som hadde respons på behandling, 9 som døde under behandlingen og 2 som hadde refraktær eller progressiv sykdom.
Tabell 1
Førstelinjebehandling av pasienter ≥ 65 år med akutt myelogen leukemi som ikke var kandidater for allogen stamcelletransplantasjon, og som ble behandlet ved Akershus universitetssykehus i perioden 1.1.2006–1.1.2021.
| Behandling | Antall pasienter | |
|---|---|---|
| Intensiv kjemoterapi | ||
| Antrasyklin og cytarabin (3 + 7 dager) | 32 | |
| Antrasyklin og cytarabin (2 + 5 dager) | 8 | |
| Amsakrin, cytarabin og etoposid (5 dager) | 2 | |
| Standard lavintensiv kjemoterapi | ||
| Azacitidin | 26 | |
| Decitabin | 2 | |
| Lavdose cytarabin | 10 | |
| Annen lavintensiv kjemoterapi1 | 5 | |
| Kun støttende behandling, inkludert hydroksyurea | 71 | |
| Totalt antall pasienter | 156 | |
1Lenalidomid, imatinib, alkeran eller redusert dose mitoksantron
Av de 151 pasientene var 84 (57 %) menn (tabell 2). Median alder var 76 år (65–93 år). Det forelå tumorgenetiske analyser til risikoklassifisering for 88 pasienter, hvorav 47 pasienter var i intermediær risikogruppe.
Tabell 2
Karakteristika og behandling for pasienter ≥ 65 år med akutt myelogen leukemi som ikke var kandidater for allogen stamcelletransplantasjon, og som ble behandlet ved Akershus universitetssykehus i perioden 1.1.2006 - 1.1.2021. Antall (%) dersom annet ikke er angitt.
| Alle pasienter | Intensiv kjemoterapi | Lavintensiv kjemoterapi | Kun støttende behandling | ||
|---|---|---|---|---|---|
| Median alder (minimum – maksimum), år | 76 (65–93) | 72 (65–90) | 76 (65–87) | 80 (68–93) | |
| Menn | 84 (57) | 26 (62) | 18 (47) | 40 (56) | |
| Akutt myelogen leukemi sekundært til annen hematologisk sykdom | 75 (57)1 | 14 (38)1 | 21 (68)1 | 40 (63)1 | |
| Tumorgenetisk svarrapport tilgjengelig | 88 (58) | 38 (90) | 30 (79) | 20 (28) | |
| Risikoklassifikasjon2 | |||||
| Gunstig | 17 (19) | 12 (32) | 4 (13) | 1 (5) | |
| Intermediær | 47 (53) | 19 (50) | 15 (50) | 13 (65) | |
| Ugunstig | 24 (27) | 7 (18) | 11 (37) | 6 (30) | |
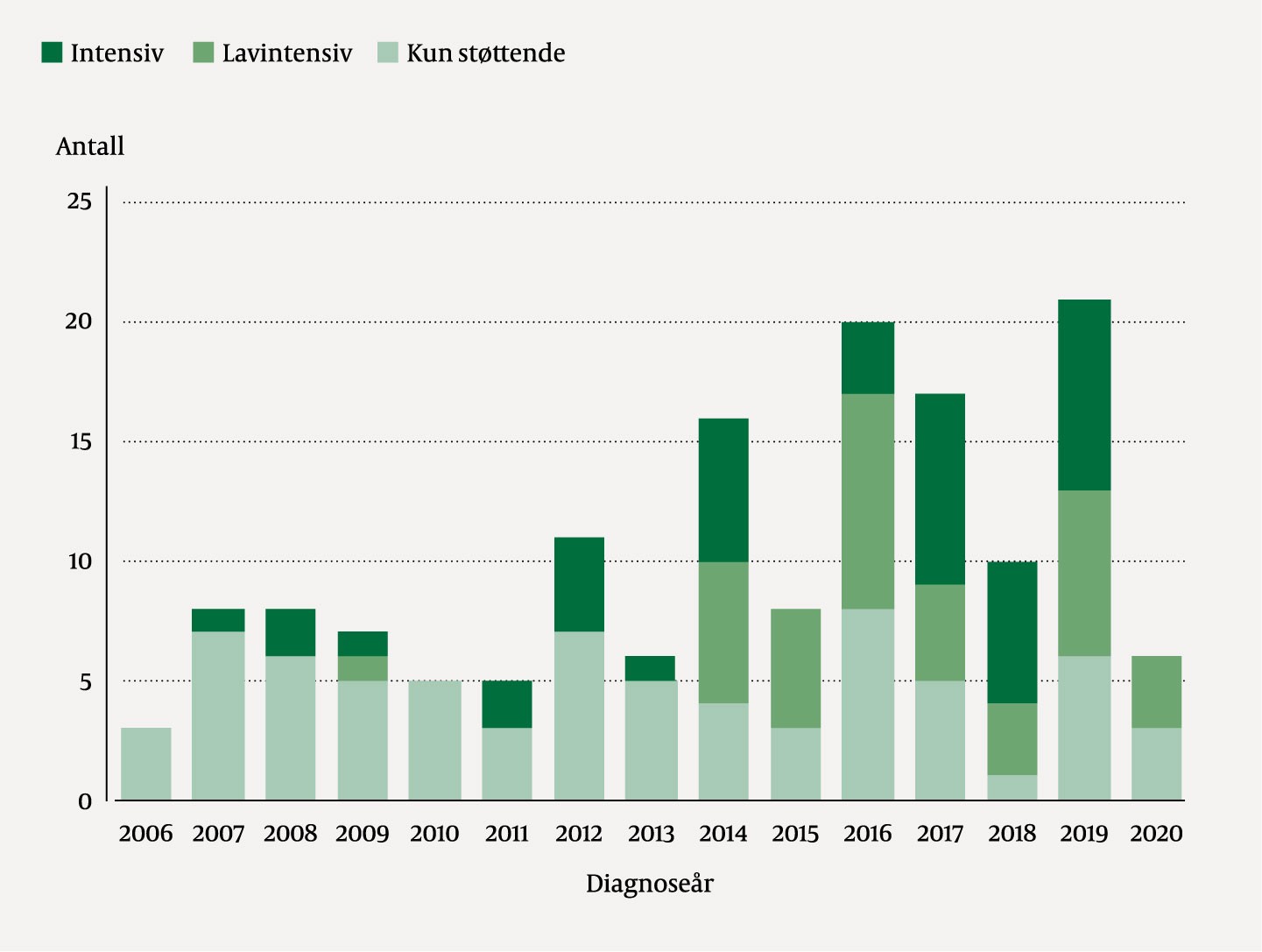
Fordelingen av de ulike førstelinjebehandlingene endret seg i perioden. Kun støttende behandling var vanligere i perioden 2006–13, mens fra 2014 utgjorde lavintensiv kjemoterapi en vesentlig del av behandlingene (figur 1).
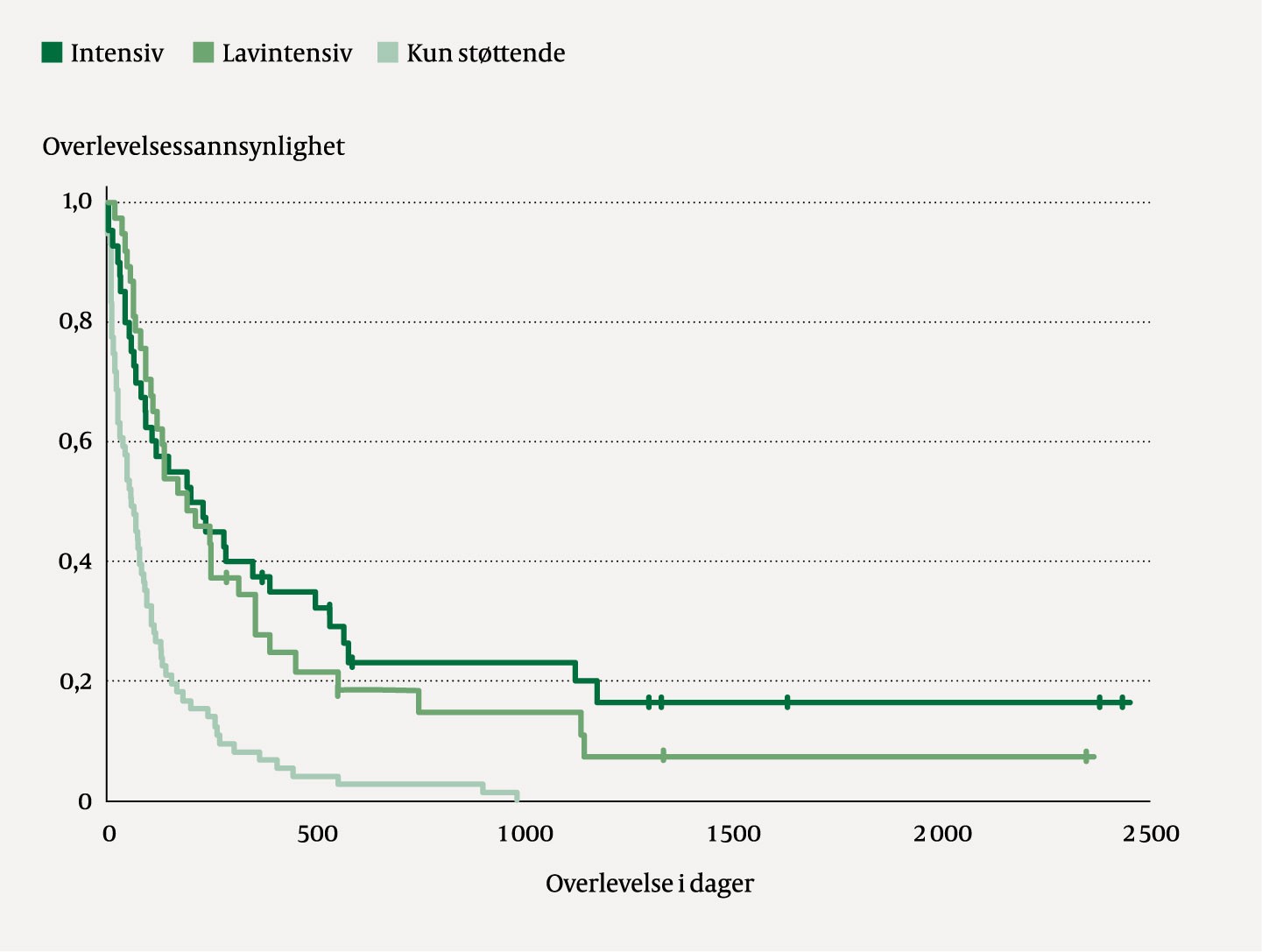
Figur 2 viser overlevelse etter gitt førstelinjebehandling. Median overlevelse for kun støttende behandling var 52 dager. For lavintensiv kjemoterapi var median overlevelse 187 dager og for intensiv kjemoterapi 195 dager (p = 0,53). Det var noen få langtidsoverlevere blant pasientene, de hadde enten fått behandling med intensiv kjemoterapi eller lavdose cytarabin.
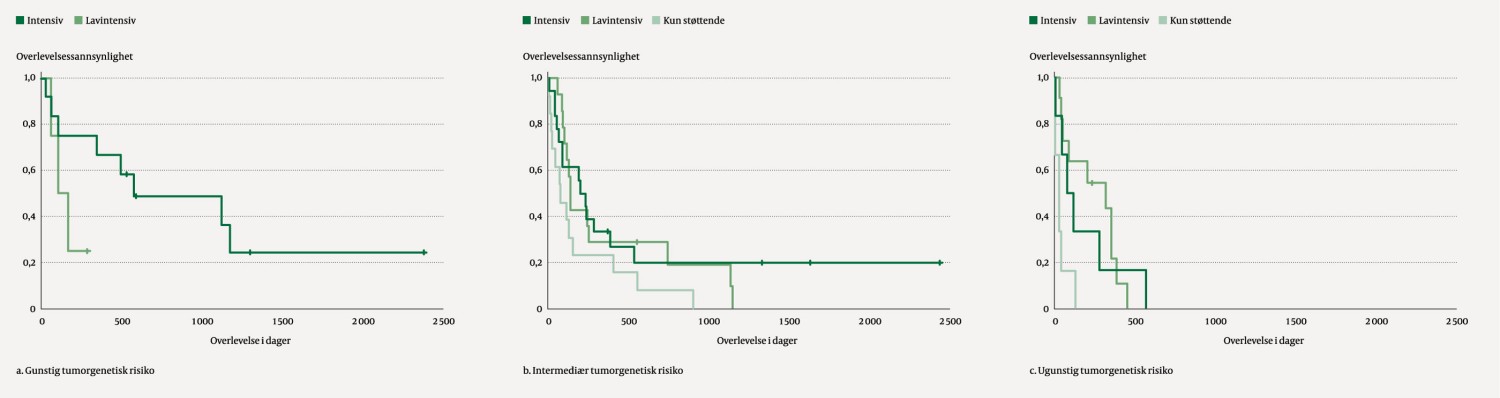
Overlevelse etter risikoklassifisering for de forskjellige behandlingskategoriene er vist i figur 3. Ingen pasienter klassifisert med ugunstig risiko levde lenger enn to år. Det var ingen statistisk signifikante forskjeller i overlevelse mellom lavintensiv og intensiv kjemoterapi innad i de forskjellige tumorgenetiske risikokategoriene. Pasienter med gunstig tumorgenetisk risiko behandlet med intensiv kjemoterapi hadde median overlevelse 573 dager, mot 101 dager blant dem som fikk lavintensiv kjemoterapi (p = 0,09).
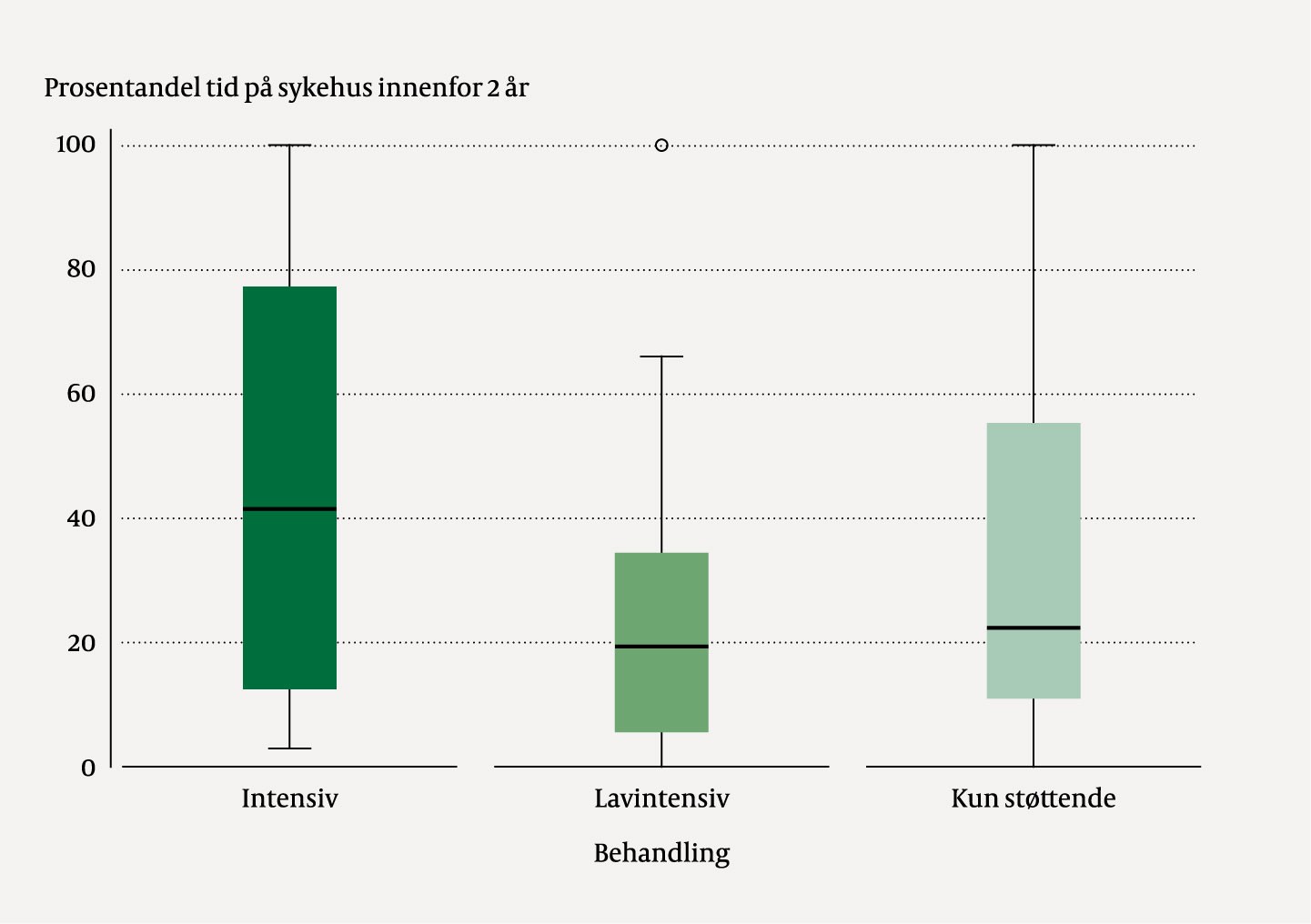
Andelen dager innlagt i sykehus innenfor to år fra diagnosen var satt, varierte (figur 4). Pasienter behandlet med intensiv kjemoterapi så ut til å ha flere innleggelsesdager i sykehus enn dem som ble behandlet med lavintensiv kjemoterapi (p = 0,06).
Diskusjon
Dette er etter hva vi kjenner til den første studien av eldre, norske pasienter som får behandling for akutt myelogen leukemi. Studien viser at behandlingen for denne diagnosen hos eldre som ikke er kandidater for allogen stamcelletransplantasjon, har endret seg fra hovedsakelig støttende behandling i 2006 til hovedsakelig lavintensiv og intensiv kjemoterapi i 2021. Pasientene som fikk intensiv kjemoterapi, var dem som lå mest på sykehus. Videre tydet dataene på at intensiv kjemoterapi kan gi bedre overlevelse ved sykdom med gunstig tumorgenetisk risiko, mens ved ugunstig tumorgenetisk risiko var overlevelsen kortvarig uavhengig av type behandling.
Det er noen få andre studier der man har undersøkt tumorgenetisk risiko, behandlingsvalg og prognose hos eldre med akutt myelogen leukemi. I en observasjonsstudie fra USA fant man at type behandling og tumorgenetisk risiko etter klassifiseringen til National Comprehensive Cancer Network var assosiert med overlevelse hos pasienter over 70 år (7). Den samme studien viste at hypometylerende behandling ga lengre median overlevelse enn intensiv kjemoterapi. I en studie som brukte klassifiseringen til European LeukemiaNet fra 2010 (12), fant man at alle pasienter over 60 år som fikk intensiv kjemoterapi uten allogen stamcelletransplantasjon og som var klassifisert i ugunstig risikogruppe, døde innen fem år, mens 30 % av de som var klassifisert i gunstig risikogruppe var fortsatt i live etter fem år (13).
I en nyere studie med validering av tumorgenetisk risiko etter European LeukemiaNet 2017-klassifiseringen (11) blant pasienter med akutt myelogen leukemi som fikk intensiv kjemoterapi og de sprekeste fikk allogen stamcelletransplantasjon, fant man at blant pasienter over 60 år var det 6,4 % som overlevde fem år hvis de var i ugunstig risikogruppe. En oppdatert gjennomgang av det svenske registeret for akutt myelogen leukemi viste at hypometylerende behandling og intensiv kjemoterapi ga omtrent samme overlevelse og at lav og intermediær tumorgenetisk risiko var assosiert med lav overlevelse uavhengig av behandling (14). En retrospektiv gjennomgang av eldre pasienter med akutt myelogen leukemi fra Italia avdekket ingen forskjell i overlevelse mellom hypometylerende behandling og intensiv kjemoterapi, men at det var noen få langtidsoverlevere blant dem som fikk intensiv kjemoterapi (10).
Det er ikke gjort randomiserte studier blant eldre der man direkte sammenlikner intensiv kjemoterapi med noen av de lavintensive kjemoterapiregimene, men i to randomiserte studier er hypometylerende behandling med azacitidin sammenliknet med «standard behandling», som var forskjellige behandlinger valgt av behandlende lege (15, 16). I disse studiene kom azacitidin bedre ut enn «standard behandling», men det er uklart om azacitidin er bedre eller dårligere enn intensiv kjemoterapi eller lavdose cytarabin. I vår studie var det noen få langtidsoverlevere – disse fikk behandling med intensiv kjemoterapi eller lavdose cytarabin, mens det var ingen langtidsoverlevere blant dem som fikk hypometylerende behandling. Det kan tyde på at det finnes enkelte varianter av akutt myelogen leukemi som responderer spesielt godt på cytarabin (17).
Så mange som 47 % av pasientene i vårt materiale fikk kun støttende behandling. Det har vært argumentert at pasienter som kun får støttende behandling, vil tjene på å få lavintensiv kjemoterapi, og at kun støttende behandling kan være å underbehandle pasienten (18).
Førstelinjebehandling for akutt myelogen leukemi har endret seg gjennom studieperioden, fra hovedsakelig støttende behandling i første del til mer bruk av lavintensive regimer og intensiv kjemoterapi i siste del av studieperioden. Det er flere årsaker til variasjonen i førstelinjebehandling. Pasientenes underliggende helse og vurderingen av hva pasienten tåler påvirker hvilken behandling legen velger. Videre har det vært en kunnskapsutvikling i perioden som har ført til at flere har fått aktiv behandling, hypometylerende behandling har blitt brukt mer, og den tidligere omtalte studien fra Sverige førte nok til at flere fikk intensiv kjemoterapi (2). At det er få randomiserte studier på akutt myelogen leukemi hos eldre, gir dårligere kunnskapsgrunnlag og større rom for individuelle vurderinger og lokale behandlingstradisjoner. I tillegg har grensene for hvilke pasienter som egner seg som kandidater til allogen stamcelletransplantasjon, endret seg. Dette har nok også påvirket materialet vårt. I begynnelsen av behandlingsperioden ble trolig færre eldre behandlet med allogen stamcelletransplantasjon enn mot slutten av perioden.
Intensiv kjemoterapi ga betydelig flere dager innlagt i sykehus innenfor to år fra diagnose enn de andre behandlingene. Det er som forventet, siden intensiv kjemoterapi gir forbigående benmargsaplasi og ofte komplikasjoner med nøytropen feber, transfusjonskrevende cytopenier, elektrolyttforstyrrelser og diaré. Pasienter som får intensiv kjemoterapi, blir ofte liggende på sykehus i fire uker, eldre pasienter ofte lenger (19). Det er derfor viktig at intensiv kjemoterapi gis til pasienter der det er en reell sannsynlighet for kurasjon. I praksis betyr det at pasienten må være kandidat for allogen stamcelletransplantasjon. Trolig er det noen få eldre pasienter som tåler intensiv kjemoterapi, men ikke allogen stamcelletransplantasjon. Våre resultater kan tyde på at dersom disse pasientene skal ha en mulighet for kurasjon med intensiv kjemoterapi, kan de ikke ha ugunstig tumorgenetisk risiko.
En styrke ved vår studie er at vi har undersøkt et uselektert, populasjonsbasert pasientmateriale fra et universitetssykehus. Studien har imidlertid flere svakheter. Antallet pasienter er lavt, noe som gjør at få av funnene blir konklusive. Dette gjelder særlig analysene av de 88 pasientene som lot seg klassifisere etter tumorgenetisk risiko. En svakhet ved alle observasjonsstudier er at legen har valgt behandling ut fra en helhetsvurdering av pasienten og at behandlingsgruppene derfor ikke er direkte sammenliknbare. For eksempel er det i vårt materiale sannsynlig at legene har valgt ut de friskeste pasientene til intensiv kjemoterapi og de sykeste til kun støttende behandling. Vi har ikke registrert komorbiditet. Videre har vi kun sett på førstelinjebehandling, mens senere behandlingslinjer kan ha påvirket overlevelsen.
Alt i alt viser denne studien ingen sikker forskjell i overlevelse mellom lavintensiv og intensiv kjemoterapi blant eldre pasienter med akutt myelogen leukemi som ikke er kandidater for allogen stamcelletransplantasjon, men intensiv kjemoterapi var assosiert med flere dager innlagt på sykehus. Trolig vinner man lite på å gi pasientene intensiv kjemoterapi ved ugunstig tumorgenetisk risiko, men antagelig kan noen pasienter med gunstig tumorgenetisk risiko kureres med intensiv kjemoterapi.
Artikkelen bygger på førsteforfatters studentoppgave ved Universitetet i Oslo.
Artikkelen er fagfellevurdert.
- 1.
Reikvam H, Dalgaard J, Johansen S et al. Behandling av akutt myelogen leukemi hos eldre. Tidsskr Nor Legeforen 2019; 139. doi: 10.4045/tidsskr.18.0775. [PubMed][CrossRef]
- 2.
Juliusson G, Antunovic P, Derolf A et al. Age and acute myeloid leukemia: real world data on decision to treat and outcomes from the Swedish Acute Leukemia Registry. Blood 2009; 113: 4179–87. [PubMed][CrossRef]
- 3.
Shallis RM, Wang R, Davidoff A et al. Epidemiology of acute myeloid leukemia: Recent progress and enduring challenges. Blood Rev 2019; 36: 70–87. [PubMed][CrossRef]
- 4.
Wang ES. Treating acute myeloid leukemia in older adults. Hematology (Am Soc Hematol Educ Program) 2014; 2014: 14–20. [PubMed][CrossRef]
- 5.
Döhner H, Weisdorf DJ, Bloomfield CD. Acute Myeloid Leukemia. N Engl J Med 2015; 373: 1136–52. [PubMed][CrossRef]
- 6.
Ustun C, Lazarus HM, Weisdorf D. To transplant or not: a dilemma for treatment of elderly AML patients in the twenty-first century. Bone Marrow Transplant 2013; 48: 1497–505. [PubMed][CrossRef]
- 7.
Talati C, Dhulipala VC, Extermann MT et al. Comparisons of commonly used front-line regimens on survival outcomes in patients aged 70 years and older with acute myeloid leukemia. Haematologica 2020; 105: 398–406. [PubMed][CrossRef]
- 8.
Quintás-Cardama A, Ravandi F, Liu-Dumlao T et al. Epigenetic therapy is associated with similar survival compared with intensive chemotherapy in older patients with newly diagnosed acute myeloid leukemia. Blood 2012; 120: 4840–5. [PubMed][CrossRef]
- 9.
Bories P, Bertoli S, Bérard E et al. Intensive chemotherapy, azacitidine, or supportive care in older acute myeloid leukemia patients: an analysis from a regional healthcare network. Am J Hematol 2014; 89: E244–52. [PubMed][CrossRef]
- 10.
Maurillo L, Buccisano F, Spagnoli A et al. Comparative analysis of azacitidine and intensive chemotherapy as front-line treatment of elderly patients with acute myeloid leukemia. Ann Hematol 2018; 97: 1767–74. [PubMed][CrossRef]
- 11.
Döhner H, Estey E, Grimwade D et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel. Blood 2017; 129: 424–47. [PubMed][CrossRef]
- 12.
Döhner H, Estey EH, Amadori S et al. Diagnosis and management of acute myeloid leukemia in adults: recommendations from an international expert panel, on behalf of the European LeukemiaNet. Blood 2010; 115: 453–74. [PubMed][CrossRef]
- 13.
Röllig C, Bornhäuser M, Thiede C et al. Long-term prognosis of acute myeloid leukemia according to the new genetic risk classification of the European LeukemiaNet recommendations: evaluation of the proposed reporting system. J Clin Oncol 2011; 29: 2758–65. [PubMed][CrossRef]
- 14.
Österroos A, Eriksson A, Antunovic P et al. Real-world data on treatment patterns and outcomes of hypomethylating therapy in patients with newly diagnosed acute myeloid leukaemia aged ≥ 60 years. Br J Haematol 2020; 189: e13–6. [PubMed][CrossRef]
- 15.
Fenaux P, Mufti GJ, Hellström-Lindberg E et al. Azacitidine prolongs overall survival compared with conventional care regimens in elderly patients with low bone marrow blast count acute myeloid leukemia. J Clin Oncol 2010; 28: 562–9. [PubMed][CrossRef]
- 16.
Dombret H, Seymour JF, Butrym A et al. International phase 3 study of azacitidine vs conventional care regimens in older patients with newly diagnosed AML with >30% blasts. Blood 2015; 126: 291–9. [PubMed][CrossRef]
- 17.
Palmer D, Jones L. A Remarkable Remission: Treating HMA Refractory Transforming MDS with Single-Agent Low-Dose Cytarabine Leading to an Ongoing Six-Year OS. Case Rep Med 2020; 2020: 1540370. [PubMed][CrossRef]
- 18.
Hubscher E, Sikirica S, Bell T et al. Patterns of undertreatment among patients with acute myeloid leukemia (AML): considerations for patients eligible for non-intensive chemotherapy (NIC). J Cancer Res Clin Oncol 2021; 147: 3359–68. [PubMed][CrossRef]
- 19.
Vaughn JE, Buckley SA, Walter RB. Outpatient care of patients with acute myeloid leukemia: Benefits, barriers, and future considerations. Leuk Res 2016; 45: 53–8. [PubMed][CrossRef]