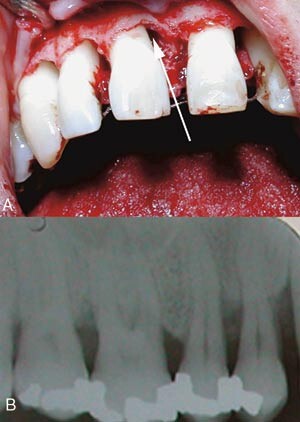
En 35 år gammel mann oppsøkte Avdeling for periodonti på grunn av vedvarende problemer med tenner og tannkjøtt. Den kliniske undersøkelsen avdekket foruten ulcerøse og nekrotiske periodontale lesjoner også at pasienten hadde et generelt stort støttevevstap rundt tennene og således en avansert periodontal sykdom (fig 1). Munnhygienen var god uten synlig dentalt plakk.
Fra litteraturen er det kjent at immunsvikt ved HIV-infeksjon er forbundet med høyere forekomst av spesielle former for gingivale og periodontale sykdommer som sjelden opptrer hos systemisk friske personer: lineært gingivalt erytem, nekrotiserende ulcerøs gingivitt og periodontitt (1) – (5). Nekrotiserende periodontale sykdommer er funnet å være assosiert med graden av pasientens immunsvikt: Prevalensen hos asymptomatiske HIV-positive pasienter er lav (< 0,5 %), men den kan stige opp mot 10 % ved progresjon av HIV-infeksjonen (1) – (5). Lavt antall CD4-positive T-lymfocytter i perifert blod har også vist seg å være signifikant assosiert med periodontalt festetap og dets utstrekning og alvorlighetsgrad (1) – (5).
På bakgrunn av det uvanlige sykdomsbildet ble pasienten derfor utredet videre med tanke på mulig bakenforliggende sykdom. Det ble utført HIV-test, differensialtelling av leukocytter og måling av immunoglobuliner i perifert blod. Det ble tatt gingivale biopsier og perifert blod fra pasienten, fra tre med kronisk periodontitt og fra tre kontrollpersoner uten periodontitt for immunfarginger og celledyrkingsstudier. Mastceller og nøytrofile granulocytter ble visualisert og telt på histologiske snitt. Monocytter ble isolert og kulturer etablert fra perifert blod. Cellekulturene ble deretter stimulert med lipopolysakkarider fra periopatogene bakterier som Actinobacillus actinomycetemcomitans og Porphyromonas gingivalis, og fra enteropatogene Escherischia Coli. Supernatantene ble deretter undersøkt ved hjelp av ELISA-teknikk for innholdet av ulike interleukiner og tumornekrosefaktor. Fullstendig laboratorieprotokoll kan fås ved henvendelse til artikkelforfatteren.
Flere nekrotiserende orale sykdommer er beskrevet. Blant disse finner vi ulceromembranøs gingivitt, akutt nekrotiserende ulcerativ gingivitt og Vincents gingivostomatitt og angina (karakterisert med nekrotiske områder i tonsillene). Felles for disse er lesjoner med predominans av fuso-spiroketale mikrober. Denne mikrofloraen deles også med den langt mer alvorlige og ofte dødelige sykdommen cancrum oris (Noma) som opptrer hos barn med systemsykdommer og/eller feilernæring i utviklingsland. En hypotese går ut på at cancrum oris utvikles fra nekrotisk gingivitt som også har høyere prevalens i utviklingsland enn i vestlige land.
Nekrotisk periodontitt forveksles ofte med primær herpetisk gingivostomatitt. Nekrotisk periodontitt opptrer som regel hos voksne personer og er begrenset til gingivale og periodontale områder (spesielt til interdentale papiller). Herpetisk gingivostomatitt rammer hyppigst barn, og lesjonene er her mer diffust spredd utover på gingiva og annen munnslimhinne. Andre orale sykdommer med mukosale lesjoner som kan forveksles med nekrotisk periodontitt, inkluderer deskvamativ gingivitt, benignt slimhinnepemfigoid, erythema multiforme exsudativum, lichen planus, lupus erythematosus og Crohns sykdom. Maligne sykdommer som leukemier kan også affisere periodontale vev og forveksles med nekrotisk periodontitt.
HIV-testen var negativ, men blodprøven avdekket et sterkt nedsatt serumnivå av immunglobuliner med følgende serumkonsentrasjoner: IgG 3,2 g/l , IgA 0,6 g/l og IgM 0,4 g/l. Totalantall leukocytter i perifert blod var 8,6 x 10⁹/l. Antallet B- og T-lymfocytter var lavt, men innenfor normalvariasjonen. Det kliniske bildet og hypogammaglobulinemien var forenlig med immunsvikt, og pasienten fikk som tentativ diagnose ervervet hypogammaglobulinemi/common variable immunodeficiency (CVID).
Ervervet hypogammaglobulinemi ble først beskrevet i 1953 og er det vanligste primære antistoffsviktsyndrom med ukjent etiologi hos mennesker. Prevalensen er 1/30 000 (6). Kjennetegn er markert reduksjon i nivået av serumantistoffer, residiverende bakterielle infeksjoner og en økt risiko for autoimmune og ondartede sykdommer (7). Selv om de bakenforliggende immunologiske defektene som forårsaker ervervet hypogammaglobulinemi fortsatt er ukjente, så har en rekke immunologiske abnormaliteter blitt identifisert og beskrevet. T-celledefekter inkluderer nedsatt aktivering og proliferasjon (8, 9) og inadekvat cytokinproduksjon (8, 9).
Den videre anamnese fortalte at pasienten siden 20 års alder hadde vært behandlet for epilepsi. De siste to årene hadde han ikke hatt noen anfall. Han brukte karbamazepin som antiepileptikum.
Det er blitt beskrevet at fenytoinpreparater kan utløse ervervet hypogammaglobulinemi hos genetisk predisponerte personer. Man kan derfor stille spørsmål om behandling med karbamazepin også kan utløse sykdom hos spesielt disponerte?
I alle biopsiene ble mastceller sett i nær tilknytning til blodårer og nerver, og ofte beliggende subepitelialt. Mastcellene var også mer spredt i bindevevet enn de nøytrofile granulocyttene som var mer fokusert mot tannen og periodontallommen.
Pasienten med aggressiv periodontitt hadde signifikant høyere antall av både mastceller og av nøytrofile granulocytter enn personer med og uten kronisk periodontitt (p < 0,05, Mann-Whitneys tester) (fig 2). Tegn på mastcelleeksocytose og ekstracellulær mastcelletryptase og -kymase ble bare observert i snitt fra pasienten med aggressiv periodontitt. Dette kan indikere økt mastcelleaktivitet og degranulering hos denne pasienten, og ikke hos de to andre gruppene. Et annet tegn på dette var ekstracellulær matriksmetalloproteinase-1 nær matriksmetalloproteinase-1-positive mastceller.
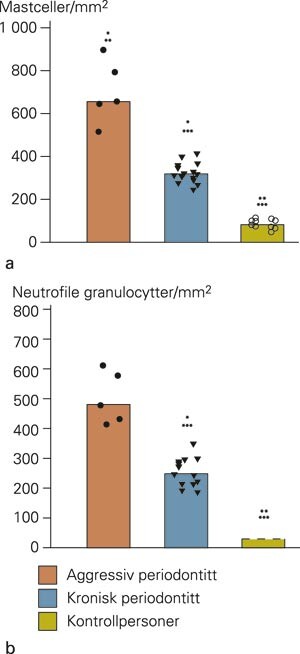
En stor andel av mastcellene hos pasienten med aggressiv periodontitt (46 %) uttrykte HLA-DR-molekyler sammenliknet med pasientene med kronisk periodontitt (28 %) og kontrollpersonene (20 %) (p < 0,05, Mann-Whitneys tester). Mastcellene farget sterkt for matriksmetalloproteinase-1 på alle snittene uavhengig av gruppe. En høyere andel av mastcellene hos pasienten med aggressiv periodontitt produserte tumornekrosefaktor (78 %) sammenliknet med dem med kronisk periodontitt (54 %) og kontrollpersonene (48 %) (p < 0,05, Mann-Whitneys tester).
Massiv mastcelleproduksjon av tumornekrosefaktor kan føre til en økt lokal akkumulering av nøytrofile granulocytter med fare for vevsdestruksjon. Mastcelle matriksmetalloproteinase-1 kan spalte opp fibrøst kollagen og derfor være en viktig faktor i nedbrytningen av bindevevet ved periodontitt.
Monocyttkulturer ble tilsatt lipopolysakkarider fra periopatogene bakterier som A actinomycetemcomitans og P gingivalis og fra enteropatogene E Coli.
Monocytter fra pasienten med aggressiv periodontitt viste økt produksjon av inflammatoriske cytokiner, men lavere sekresjon av det antiinflammatoriske cytokinet interleukin-10. Dette kan bety at pasienten har en inflammatorisk fenotype med senket terskel for å danne inflammasjon. Dette kan være en sentral faktor i hans sykdom og årsak til det uttalte tapet av periodontalt støttevev (fig 1).
Periodontalt ble den akutte situasjonen behandlet med subgingival tannrengjøring kombinert med metronidazolterapi. Pasienten går nå til regelmessige kontroller og oppfølging ved Avdeling for periodonti. Han mottar også regelmessige immunglobulininjeksjoner på grunn av sin hypogammaglobulinemi. De orale, gingivale og periodontale forholdene er nå relativt stabile. Forholdene bedret seg raskt etter at det ble igangsatt IgG-substitusjonsbehandling og gjennomført systematisk periodontal behandling. Dette støtter antakelsen om at immunglobuliner har en viktig rolle i det periodontale forsvar.
Diskusjon
Sykehistorien er et eksempel på at aggressiv periodontitt kan være assosiert med immunsvikt. Aggressiv nekrotisk periodontitt er vanlig hos HIV-positive pasienter, og forekomsten øker med graden av immunsvikt og med fallende antall CD4-positive T-lymfocytter (1) – (5). Hos vår pasient, derimot, beror immunsvikten delvis på en mangelfull produksjon av antistoffer (6, 7). Dette resulterte i nedsatt evne til å kontrollere bakterielle og virale infeksjoner (6, 7).
Økningen i antall mastceller og nøytrofile granulocytter kan være et kompensatorisk forsøk på å kontrollere den periodontale infeksjonen. Disse celletypene er sentrale i vevsnedbrytning, med stor produksjon og frigivelse av kollagenaser, gelatinaser og proteaser (3) – (5). I tillegg spiller disse cellene viktige roller i anabole tilhelingsprosesser som pågår samtidig med de vevsdestruktive katabole prosessene under en inflammasjon. De er også viktige produsenter av inflammatoriske cytokiner, noe som understrekes ved at en høy andel mastceller hos pasienten var positive for tumornekrosefaktor. Tumornekrosefaktor er et viktig inflammasjonsdrivende cytokin som også virker kjemotaktisk på nøytrofile granulocytter. Tumornekrosefaktor fra mastcellene kan derfor være en viktig årsak til den økte mengden nøytrofile granulocytter i gingiva. Videre vil en hyperrespons hos monocyttene med økt sekresjon av inflammasjonsdrivende cytokiner øke tilbøyeligheten til vevsødeleggende prosesser. Overnevnte faktorer kan bidra til utviklingen av nekrotiske periodontale lesjoner (fig 1). En massiv frigjøring av potente vevsdestruktive mediatorer kan ha forårsaket festetapet med danning av dype beinlommer hos vår pasient (fig 1).
Aggressiv nekrotisk periodontitt kan være første kliniske tegn på immunsvikt og hypogammaglobulinemi (10). Sykehistorien til vår pasient viser hvor viktig en adekvat immunglobulinproduksjon kan være for å kontrollere en periodontal infeksjon og at samtidig hyperaktivitet i det uspesifikke immunforvar med økt produksjon av inflammatoriske cytokiner kan være en medvirkende faktor i utviklingen av aggressive periodontitter.
Manuskriptet ble godkjent 16.2. 2005.
Oppgitte interessekonflikter: Ingen
Se kommentar side 615
- 1.
Holmstrup P. Periodontal diseases in HIV-infected patients. J Clin Periodontol 1994; 21: 270 – 80.
- 2.
Steinsvoll S, Aass AM. En pasient med periodontitt, oral candidiasis og uoppdaget HIV-infeksjon Tidsskr Nor Lægeforen 2002; 122: 702 – 3.
- 3.
Steinsvoll S, Myint MM, Odden K et al. Reduced serum IgG reactivities with bacteria from dental plaque in HIV-infected persons with periodontitis. J Clin Periodontol 1997; 24: 823 – 9.
- 4.
Myint M, Steinsvoll S, Yuan ZN et al. Highly increased numbers of leukocytes in inflamed gingiva from patients with HIV infection. AIDS 2002; 16: 235 – 43.
- 5.
Næsse EP, Schreurs O, Helgeland K et al. Matrix metalloproteinases and their inhibitors in gingival mast cells in persons with and without human immunodeficiency virus infection. J Periodont Res 2003; 38: 575 – 82.
- 6.
International Union of Immunological Societies. Primary immunodeficiency diseases. Report of an IUIS Scientific Committee. Clin Exp Immunol 1999; 118: 1 – 28.
- 7.
Spickett GP. Current perspectives on common variable immunodeficiency (CVID). Clin Exp Allergy 2001; 31: 536 – 42.
- 8.
Pastorelli G, Roncarolo MG, Touraine JL et al. Peripheral blood lymphocytes of patients with common variable immunodeficiency (CVI) produce reduced levels of interleukin-4, interleukin-2 and interferon-gamma, but proliferate normally upon activation by mitogens. Clin Exp Immunol 1989; 78: 334 – 40.
- 9.
Sneller MC, Strober W. Abnormalities of lymphokine gene expression in patients with common variable immunodeficiency. J Immunol 1990; 144: 3762 – 9.
- 10.
Rump JA, Jahreis A, Schlesier M et al. Possible role of IL-2 deficiency for hypogammaglobulinemia in patients with common variable immunodeficiency. Clin Exp Immunol 1992; 89: 204 – 10.