Preeklampsi er en dominerende årsak til sykdom og død hos gravide kvinner og foster, med en insidens på 1 – 5 % på verdensbasis (1, 2). Til tross for at sykdommen har vært gjenstand for intens og økende interesse gjennom et helt århundre, er det fortsatt uklart hvordan den oppstår. I dag regnes det for sannsynlig at det preeklamptiske sykdomsbildet er resultat av en rekke forskjellige patogenetiske og patofysiologiske mekanismer med ett felles utgangspunkt; placentavev må være til stede (3).
Tidsskriftet publiserte en oversiktsartikkel om dette temaet i 2000 (2). Nye metoder innen molekylærbiologi og genteknologi har gitt ny viten, og denne artikkelen er basert på forskningsresultater, fremkommet de siste par år, som kan bidra til å belyse mulige sykdomsmekanismer.
Sykdomsutviklingen – en totrinnsprosess?
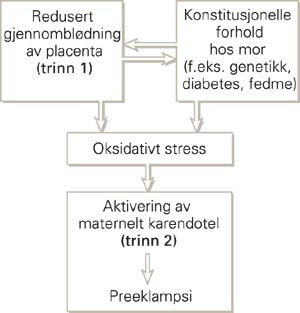
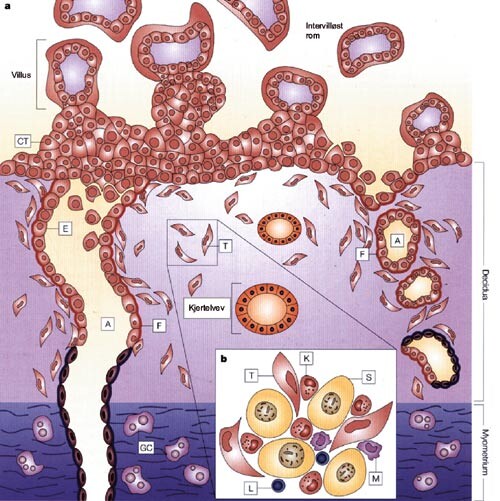
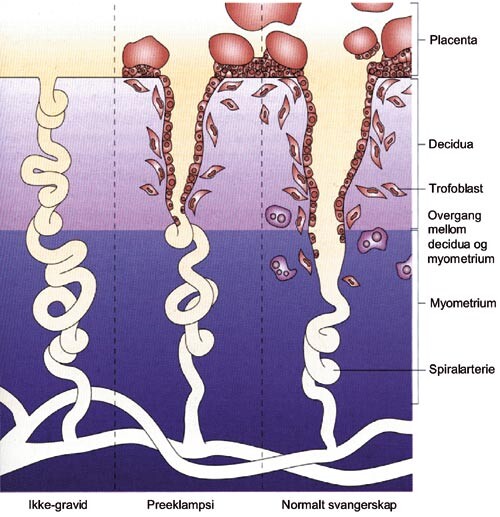
Det kan være hensiktsmessig å tenke på utviklingen av preeklampsi som en totrinnsprosess (3). Startpunktet, eller trinn 1, er en placenta med redusert blodgjennomstrømning (fig 1) (3). Under graviditet står de uterine spiralarteriene for blodforsyningen til det intervilløse rom i placenta. Normalt øker disse sterkt i diameter og mister sin følsomhet for vasoaktive substanser. Dette skyldes at karendotel og glatt muskulatur brytes ned eller blir erstattet av invaderende trofoblaster (fig 2) (4). Den dårlige blodforsyningen til placenta ved preeklampsi karakteriseres av mangelfull trofoblastinvasjon og utilstrekkelig eller fraværende omdanning av uterine kar (fig 3) (4, 5).
Selv om en placentær iskemi betraktes som et sine qua non i patogenesen av preeklampsi, er det ikke slik at iskemi nødvendigvis fører til utvikling av preeklamptiske symptomer. Det er velkjent at placenta fra svangerskap med prematur fødsel og/eller intrauterin vekstretardasjon kan vise patologiske endringer svarende til dem som påvises i forbindelse med preeklampsi (6). Dette innebærer at utviklingen av preeklampsi synes å være avhengig av den gravide kvinnens respons på den placentære iskemien. Konstitusjonelle faktorer ser ut til å være av betydning for den maternelle responsen. Økt preeklampsirisiko har vært påvist hos kvinner med nedsatt antioksidantaktivitet, økt følsomhet for oksygenradikaler eller økt tendens til endotel aktivering (7).
Et normalt fungerende karendotel frigjør en rekke faktorer som bidrar til å opprettholde kartonus og permeabilitet, hemme leukocyttadhesjon og -migrasjon, samt hindre trombocyttaktivering og -aggregering. Aktivering av maternelt endotel er en forutsetning for at preeklamptiske manifestasjoner skal utvikle seg (3, 7) og regnes som trinn 2 i sykdomsutviklingen. Forbindelseslinjen mellom placentasykdommen og aktivering av maternelt karendotel er ikke endelig avklart; både økt oksidativt stress (3, 7) og/eller patologisk forhøyet inflammatorisk respons (8) har vært fremført som mulige forklaringer.
Immunologiske forhold ved implantasjon
Trofoblastene er byggesteinene til placenta. Disse cellene er av føtal opprinnelse. På grunn av arv fra far kan enheten foster/placenta i prinsippet betraktes som et semiallograft i mors organisme. I grensesonen mellom føtalt og maternelt vev kommer trofoblaster i direkte kontakt med maternelle leukocytter, og mangelfull implantasjon og utvikling av placenta kan sannsynligvis i mange tilfeller tilskrives immunologiske reaksjoner generert av møtet mellom føtale og maternelle celler, med hemmet trofoblastinvasjon som resultat. Naturlige drepeceller (natural killer cells; NK-celler) utgjør bortimot 80 % av leukocyttpopulasjonen i decidua i første trimester (4, 5). Drepeceller i decidua er fenotypisk forskjellige (CD56+/CD16 –) fra drepeceller i perifert blod (CD56+/CD16+) og viser lavere cytotoksisitet (4). Drepecellene regulerer sannsynligvis trofoblastenes invasjon i uterint vev gjennom interaksjon med antigener på trofoblastenes overflate, med påfølgende cytokinproduksjon (4, 5). En rekke cytokiner er påvist i grensesonen mellom maternelt og føtalt vev (9).
Nivået av cytokiner påvirker ekspresjonen av adhesjonsmolekyler i maternelt vev. En synkronisert ekspresjon av adhesjonsmolekyler er nødvendig for adekvat trofoblastinvasjon og angiogenese. En rekke rapporter melder om endrede nivåer av cytokiner intrauterint i forbindelse med preeklampsi og/eller føtal vekstretardasjon (10). Disse endringene kan ligge til grunn for den abnorme ekspresjonen av adhesjonsmolekyler og integriner som er påvist i decidua fra svangerskap med mangelfull placentautvikling og preeklampsi og bidra til å forklare den utilstrekkelige angiogenesen (11).
Vevsforlikelighetsantigener
En rekke mekanismer bidrar til at fosteret er beskyttet mot maternelle forsvarsmekanismer. At det føtale semiallograft er totalt innkapslet av trofoblaster, er sannsynligvis av vesentlig betydning. Trofoblastpopulasjonen som invaderer maternelt vev (ekstravilløse trofoblaster), uttrykker HLA-C av de klassiske HLA-klasse I-molekylene, og HLA-E og HLA-G av den ikke-klassiske varianten (4) (fig 2). I den menneskelige organisme uttrykkes HLA-G ellers bare av celler i amnion og thymus. HLA-G har sannsynligvis liten immunstimulerende effekt på grunn av få alleler (4). HLA-C, HLA-E og HLA-G samvirker med reseptorer, såkalte drepecelleimmunglobulinliknende reseptorer (killer cell immunglobulin-like receptors, KIR) og CD94/NKG2, som uttrykkes av drepeceller og enkelte subgrupper av T-lymfocytter (tab 1) (4). Binding av HLA-C, HLA-E og HLA-G til disse reseptorene medfører at hemmende eller stimulerende signaler utløses (4). Det stimuleres til produksjon av cytokiner med immundempende effekter, som normalt fører til en dreining av den gravide kvinnens T-lymfocyttrespons (fra Th8 til Th2) (12). Interaksjonen mellom trofoblaster og drepeceller foregår i et komplekst samvirke mellom HLA-C, HLA-E og HLA-G (4).
Tabell 1
Trofoblastantigener og drepecellereseptorer
| Trofoblastantigen¹ |
Drepecellereseptor |
Funksjon² |
| HLA-C |
KIR2DL1 – 3 KIR2DS |
Kommuniserer fars identitet |
| HLA-G |
ILT2 KIR2DL4 |
Forteller at en placenta er under utvikling |
| HLA-E |
CD94/NKG2A CD94/NKG2C |
Deltar i bindingen av HLA-G, hemmer drap av trofoblastene |
| [i] | ||
[i] ¹ Vevsforlikelighetsantigener på overflaten av ekstravilløse trofoblaster gjenkjennes av spesifikke reseptorer på uterine drepeceller. Gjenkjenning utløser stimulerende eller hemmende signaler (4)
² De forskjellige antigenreseptorparene har trolig spesifikke funksjoner i interaksjonen mellom føtale og maternelle celler (4)
Trofoblastenes HLA-C kommuniserer sannsynligvis fars identitet, HLA-E inngår trolig som ledersekvens i bindingen av HLA-G (og bidrar til at signalene blir hemmende), mens HLA-G signaliserer at en placenta er under utvikling (tab 1) (4). In vitro-studier viser at HLA-G beskytter mot drap av drepeceller (13), og høye nivåer av løselig HLA-G er påvist hos gravide (12). Det er antatt at de høye konsentrasjonene av løselig HLA-G også bidrar til å dreie immunresponsen i Th2-retning under graviditet (12). En rekke studier tyder på at fars/fosterets genotype er av betydning for at preeklampsi utvikler seg (1). Analyser av arvelighetsmønsteret kan tyde på at det er selve interaksjonen mellom den maternelle og den paternelle genotypen som er den underliggende prosess (1, 7). Ifølge nye forskningsresultater skjer dette kanskje innenfor rammen av samspillet mellom trofoblast HLA-C og reseptorer på drepecellene (KIR).
Ekstravilløse trofoblaster fra preeklamptiske svangerskap viser redusert eller fraværende ekspresjon av HLA-G (14) og økt drepecellecytotoksisitet (15). Dette kan innebære at trofoblastenes møte med drepecellene ved denne tilstanden ender med drap og en overflatisk trofoblastinvasjon i maternelt vev.
Induksjon av apoptose
Grensesonen mellom føtalt og maternelt vev er utstyrt med spesielle immunbeskyttelsesmekanismer. Induksjon av apoptose, programmert celledød, er en mekanisme som bidrar til immunbeskyttelse. Apoptose kan induseres ved binding av såkalte dødsligander til de respektive reseptorer. En rekke av dødsligandene tilhørende tumornekrosefaktor (TNF)-familien deltar. Disse kan indusere apoptose ved å binde seg til reseptorer av TNF-reseptor (TNFR)-superfamilien. Fas (CD95) og TRAIL (TNF Related Apoptosis Inducing Ligand)-R er eksempler på overflateprotein som tilhører TNFR-superfamilien. Aktiverte leukocytter uttrykker Fas og TRAIL-R. Trofoblaster uttrykker ligandene for Fas og TRAIL-R (FasL, TRAIL), og apoptose induseres i aktiverte leukocytter (som uttrykker Fas og TRAIL-R) ved kontakt (16).
Når det gjelder preeklampsi, er det gjort interessante observasjoner vedrørende Fas/FasL. Det er rapportert om både økt antall drepeceller (17) og økt Fas-ekspresjon (18). Disse funnene kan tyde på at preeklampsi er assosiert med økt cytotoksisitet rettet mot det føtale semiallograft. Videre ser det ut til at trofoblastene har en redusert ekspresjon av FasL (19). Til sammen innebærer dette at trofoblastene kan være mer utsatt for leukocyttindusert apoptose i preeklamptiske enn i normale svangerskap, og økt forekomst av apoptose blant ekstravilløse trofoblaster er rapportert (20). Slik kan trofoblastinvasjonen bli overflatisk og utviklingen av placenta rammes.
Trofoblastdefekt eller økt maternelt angrep?
Enkelte resultater tyder på at de ekstravilløse trofoblastene ved preeklampsi har egenskaper som kanskje kan forklare den mangelfulle invasjonen (14, 15, 19). Andre observasjoner tilsier at økt angrep fra det maternelle immunsystem ligger under (15, 17, 18). Den rådende oppfatning nå er at det er samvirket mellom de ekstravilløse trofoblaster og maternelle immunkompetente celler som er avgjørende; placentasykdommen oppstår som resultatet av den rekken av hendelser som utløses av denne interaksjonen.
Genetisk disposisjon og arv
En rekke studier tyder på at genetiske faktorer spiller en viktig rolle for at preeklampsi oppstår (1, 7). Den sterkeste genetiske assosiasjonen synes å være knyttet til den maternelle disposisjonen (1, 7). Assosiasjon mellom preeklampsi og mulige kandidatgener har vært studert, så som gener med betydning for blodtrykksregulering og nivåene av lipoproteinlipase, metylentetrahydrofolatreduktase, faktor V Leiden, apolipoprotein E og protrombin, uten at resultatene gir grunnlag for sikre konklusjoner (7). Det er heller ikke påvist assosiasjon mellom disposisjon for preeklampsi og HLA-varianter på genotypenivå. Arvegangen foregår åpenbart ikke etter konvensjonelle regler (7), og det er i dag en gjengs oppfatning at denne er under multifaktorial kontroll (1, 7).
Koblingssøk i det humane genom
Koblingsstudier rettet mot det humane genom er en egnet innfallsvinkel ved tilstander med sterk genetisk komponent uten kjent lokalisasjon. Dette er imidlertid en svært kostbar metode som forutsetter tilgang på materiale fra mange familier med flere affiserte. Det at tilstanden bare rammer det ene kjønn og at kategorisering som frisk/affisert kun kan gjøres etter gjennomgått svangerskap, gjør tilgangen på studier av nødvendig størrelse ytterst begrenset. I en studie ble det funnet kobling til 4q, men observasjonen ble ikke bekreftet i senere undersøkelser (7). Kobling mellom preeklampsi og 7q36 (som inneholder eNOS-locus knyttet til regulering av blodtrykk) er usikkert. Både positive og negative funn er rapportert (7). I en islandsk studie er det funnet kobling til 2p13, noe som understøttes av australske data (1, 7). Den australske forskningsgruppen har foreslått å kalle den aktuelle region på kromosom 2 for PREG1 (PRe-eclampsia, Eclampsia Gene 1)-locus (7). I samarbeid med den australske forskningsgruppen planlegger vi å utdype disse funnene i en studie av familier med preeklampsi som inngår i Helseundersøkelsen i Nord-Trøndelag (HUNT II).
Placentasykdom og maternelt syndrom
Det er ikke avklart hvordan den mangelfulle placentautviklingen (trinn 1) gir opphav til endotel aktivering og det maternelle syndrom (trinn 2). Den placentære iskemi/hypoksi fører sannsynligvis til at en rekke faktorer frigjøres til den maternelle sirkulasjonen, med de karakteriske patofysiologiske endringene som resultat. En rekke studier tyder på at interaksjonen mellom placentære og maternelle faktorer skaper en situasjon med økt oksidativt stress som bidrar til aktivering av karendotel (3, 7). Andre antar at aktiveringen forårsakes av en økt inflammatorisk respons, blant annet forårsaket av økt avskalling av syncytiale fragmenter inn i det intervilløse rom (8). Disse kan generere en inflammatorisk respons med frigjøring av cytokiner og endotelaktivering (8). I vår forskning har vi funnet økt forekomst av apoptose/nekrose i syncytialmembranen i forbindelse med preeklampsi, noe som understøtter antakelsen om at koblingen mellom placentasykdommen og det maternelle syndrom kan ligge i dette vevet.
Preeklampsi utvikler seg med bidrag fra både placenta og den gravide kvinnens organisme. Den relative betydning av bidraget fra hver av dem vil variere. Hos noen kvinner med tilnærmet normale responser vil det dreie seg om en utbredt placentasykdom. Hos andre vil placentasykdommen være minimal. Summen av en lett placentær hypoksi og svangerskapet i seg selv kan imidlertid, hos kvinner med genetisk anlegg for abnorme immunresponser og lav terskel for endotelaktivering, representere en «stresstest» som overgår det kvinnen er i stand til å håndtere.
Oppgitte interessekonflikter: Ingen
- 1.
Lachmeijer AMA, Dekker GA, Pals G, Aarnoudse JG, ten Kate LP, Arngrimsson R. Searching for pre-eclampsia genes: the current position. Eur J Obstet Gynecol Reprod Biol 2002; 105: 94 – 113.
- 2.
Haram K, Bjørge L, Guttu K. Patofysiologi og kliniske manifestasjoner ved preeklampsi Tidsskr Nor Lægeforen 2000; 120: 1426 – 31.
- 3.
Roberts JM, Hubel CA. Is oxidative stress the link in the two-stage model of pre-eclampsia? Lancet 1999; 354: 788 – 9.
- 4.
Moffett-King A. Natural killer cells and pregnancy. Nature Immunol 2002; 2: 656 – 63.
- 5.
Loke YW, King A. Human implantation: cell biology and immunology. Cambridge: Cambridge University Press, 1995.
- 6.
Khong TY, De Wolf F, Robertson WB, Brosens I. Inadequate maternal vascular response to placentation in pregnancies complicated by pre-eclampsia and small-for-gestational-age infants. Br J Obstet Gynaecol 1986; 93: 1049 – 59.
- 7.
Roberts JM, Cooper DW. Pathogenesis and genetics of pre-eclampsia. Lancet 2001; 357: 53 – 6.
- 8.
Redman CWG, Sargent IL. The pathogenesis of pre-eclampsia. Gynecol Obstet Fertil 2001; 29: 518 – 22.
- 9.
Hunt JS, Petroff MG, Burnett TG. Uterine leukocytes: key players in pregnancy. Semin Cell Dev Biol 2000; 11: 127 – 37.
- 10.
Benyo DF, Smarason A, Redman CWG, Sims C, Conrad KP. Expression of inflammatory cytokines in placentas from women with pre-eclampsia. J Clin Endocrinol Metab 2001; 86: 2505 – 12.
- 11.
Fisher SJ. The placenta dilemma. Semin Reprod Med 2000; 18: 321 – 6.
- 12.
Yokoyama WM. The mother-child union: the case of missing-self and protection of the fetus. Proc Natl Acad Sci USA 1997; 94: 5598 – 6000.
- 13.
Hunt JS, Jadhav L, Chu W, Geraghty DE, Ober C. Soluble HLA-G circulates in maternal blood during pregnancy. Am J Obstet Gynecol 2000; 183: 682 – 8.
- 14.
Goldman-Wohl DS, Ariel I, Greenfield C, Hochner-Celnikier D, Cross J, Fisher SJ et al. Lack of human leukocyte antigen-G expression in extravillous trophoblasts is associated with pre-eclampsia. Hum Reprod 2000; 6: 88 – 95.
- 15.
Emmer PM, Steegers EAP, Kerstens HMJ, Bulten J, Nelen WLDM, Boer K et al. Altered phenotype of HLA-G expressing trophoblast and decidual natural killer cells in pathological pregnancies. Hum Reprod 2002; 17: 1072 – 80.
- 16.
Runic R, Lockwood CJ, Ma Y, Dispasquale B, Guller S. Expression of Fas ligand by human cytotrophoblasts: implications in placentation and fetal survival. J Clin Endocrinol Metab 1996; 81: 3119 – 22.
- 17.
Stallmach T, Hebisch G, Orban P, Lu X. Aberrant positioning of trophoblast and lymphocytes in the feto-maternal interphase with pre-eclampsia. Virchows Arch 1999; 434: 207 – 11.
- 18.
Darmochwal-Kolarz D, Leszczynska-Gorzelak B, Rolinski J, Oleszczuk J. The expression and concentrations of Fas/APO-1 (CD95) antigen in patients with severe pre-eclampsia. J Reprod Immunol 2001; 49: 153 – 64.
- 19.
Hsu CD, Harirah H, Basheera H, Mor G. Expression of Fas ligand by pre-eclamptic placenta. Am J Obstet Gynecol 2001; 180: S43.
- 20.
Genbacev O, DiFederico E, McMaster M, Fisher SJ. Invasive cytotrophoblast apoptosis in pre-eclampsia. Hum Reprod 1999; 14: 59 – 66.