About 1 500 cases of malignant melanoma are reported in Norway each year (1). Early diagnosis and appropriate surgical treatment cure many patients (80 – 90 %). Approximately 10 – 20 % of those who undergo surgery will experience local/regional recurrence or distant spreading (2). These patients require rapid evaluation and treatment. Chemotherapy has been the standard for most patients with distant spreading, but some can be offered newer types of systemic treatment that are often more targeted and more effective than chemotherapy. New drugs offer hope to this patient group after many years of stagnation in the treatment options. This publication is intended to summarise established treatment and the most recent trends in the diagnosis and treatment of patients with melanoma in Norway.
Method
The article is based on a search in PubMed for relevant publications in the period 1 January 2000 – 1 April 2013. The following key terms were used in the search: «malignant melanoma» (alone or in combination with the following key terms: «surgery», «sentinel node procedure», «chemotherapy», «immunotherapy», «radiation», «molecular biology», «BRAF», «CTLA-4» and «MEK»). The article also draws on the authors' overall clinical and research experience in connection with malignant melanoma.
Epidemiology, prophylaxis and use of solariums
Since the establishment of the Cancer Registry in Norway in 1952, the incidence of malignant skin melanoma has increased more than eightfold (1). It is now the second most prevalent form of cancer for both sexes combined in the age group 15 – 54. In 1953, the age-adjusted incidence rates (number of new cases per 100 000 per year) for women and men were 1.9 and 2.2 respectively, while the corresponding rates for 2010 were 19.6 and 19.0 (3). The largest increase is seen in the over-60 age group, particularly for men. The prevalence of malignant melanoma is more than twice as high in Southern Norway as in Northern Norway. This is attributed to different levels of exposure to the sun (dose of ultra-violet (UV) radiation, which is the most important known cause of malignant melanoma developing (4). Intermittent and intense exposure that can cause sunburn is regarded as particularly harmful. Patients with local disease have the highest survival rate. The long-term survival for advanced melanoma is low, and has improved only marginally over time.
Primary prophylaxis therefore entails protection against intense exposure to sun that can cause sunburn. The Cancer Association’s sun-sense rules recommend a break from the sun between 11 a.m. and 3 p.m. and using protective clothing and sun screen with an SPF of at least 15. A meta-analysis conducted by an international task force in collaboration with the World Health Organization (WHO) has also documented a higher risk of malignant melanoma for solarium users, and as a result people are advised not to use solariums (5). Secondary prophylaxis is now being achieved by increasing the general public’s awareness and knowledge.
Clinical characteristics
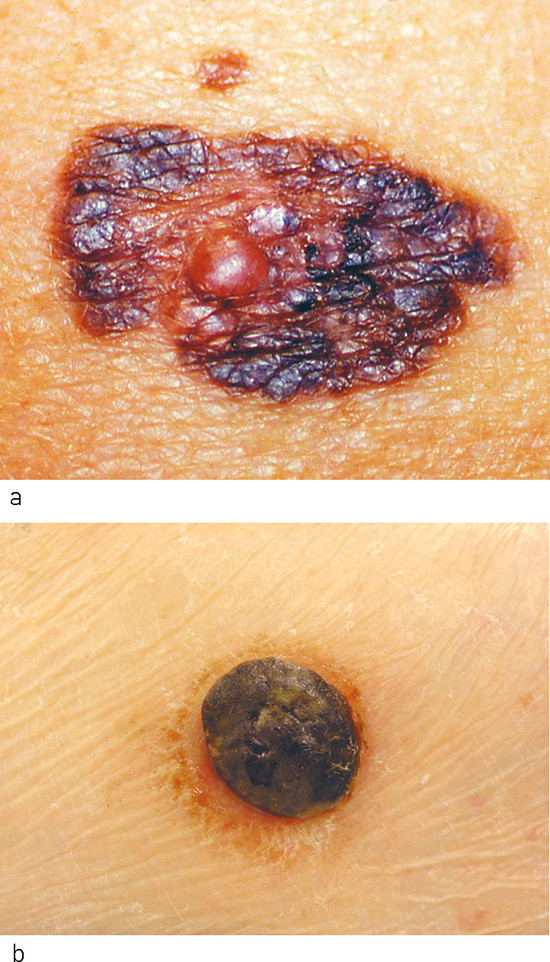
Clinical findings in connection with malignant melanoma vary. Patients’ histories combined with a clinical examination and, if indicated, dermatoscopy may add to the evidence for the diagnosis. The ABCD(E) rule (4) is useful for a clinical assessment of skin lesions (Box 1). Pigmented lesions that are distinct from the patient's other naevi («the ugly duckling») are important diagnostic features and may be a sign of melanoma development (6). For patients in high-risk groups, full-body photographs may be indicated for monitoring naevi development and detecting new lesions early. Diagnosis is based on histopathological examination in connection with an excision biopsy of the lesion. Excision biopsies can often be performed by GPs or dermatologists. In cases of particularly large lesions or location in cosmetically difficult areas, excision should be performed by a surgeon or plastic surgeon.
The ABCD(E) rule for clinical assessment of skin lesions (4)
A for Asymmetry
B for Borders
C for Colour
D for Diameter (> 6 mm)
E for Evolving
Histopathological assessment
The diagnosis of malignant melanoma is made on the basis of a histopathological examination (Fig. 1). Melanomas are classified into the following main types: superficial spreading melanoma, nodular melanoma, lentigo maligna melanoma and acral lentiginous melanoma (2) (Fig. 2). There are also rare variants, such as desmoplastic melanoma. Apart from nodular melanomas, all the main types can occur as either in-situ (non-invasive) or invasive lesions. The diagnosis «melanocytic tumour with atypia» indicates that a melanoma could not be excluded, which often means that the lesion is treated as melanoma (2). A number of features are of importance for the prognosis and treatment. The most significant variables are included in the classification of malignant melanomas as mandatory (7): tumour thickness, ulceration and mitotic rate.
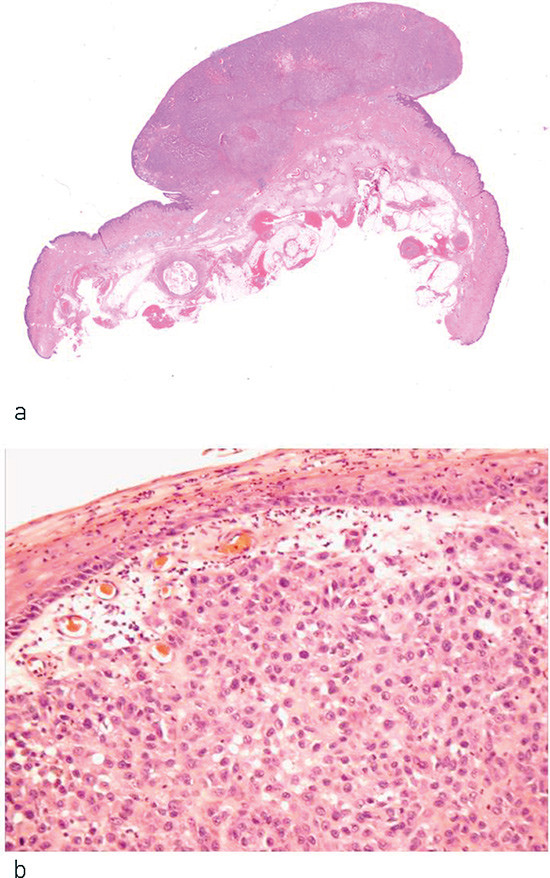
Sentinel lymph node examination is now being introduced into Norway for melanomas 1 – 4 mm thick. The procedure and benefit are explained in the national action programme for malignant melanoma, which was recently published by the Norwegian Directorate of Health (1).
Genetics
Persons with fair skin and/or many moles (e.g. as with an atypical naevus syndrome) are more predisposed to malignant melanoma than others (2). A family history of malignant melanoma may be due, for example, to a hereditary defect in the CDKN2A or CDK4 gene (8, 9), so-called dominant hereditary malignant melanoma. Extensive international cooperation is in progress under the aegis of the GenoMEL consortium to find other genes that may lead to hereditary types of malignant melanoma (10). The benefit of systematic monitoring of persons with a familial aggregation of malignant melanoma has been shown by means of clinical studies (11). If a hereditary predisposition is suspected, for example in the event of three cases of malignant melanoma among first- or second-degree relatives («rule of three»), the persons concerned should be referred to a department of medical genetics (2). Persons found to have a genetic defect should be monitored with annual check-ups at a dermatology or cancer department (1).
Surgery
Surgery is currently the only potentially curative treatment for malignant melanoma, and a correct procedure is therefore extremely important.
Primary treatment
Excision biopsy of a suspected melanoma skin lesion must remove the whole tumour plus a 2 – 5 mm margin into normal skin and a cushion of subcutaneous fat (2) (Fig. 3). The biopsy has always to be submitted for a histological examination. The results form the basis for further surgical treatment. Incision biopsy, punch biopsy and laser treatment of suspected melanoma skin lesions are not recommended, as these procedures often make it impossible to judge the thickness of the tumour. The primary health service can perform primary excision. For melanomas located in difficult areas, the patient should be referred to a dermatologist or (plastic) surgeon.
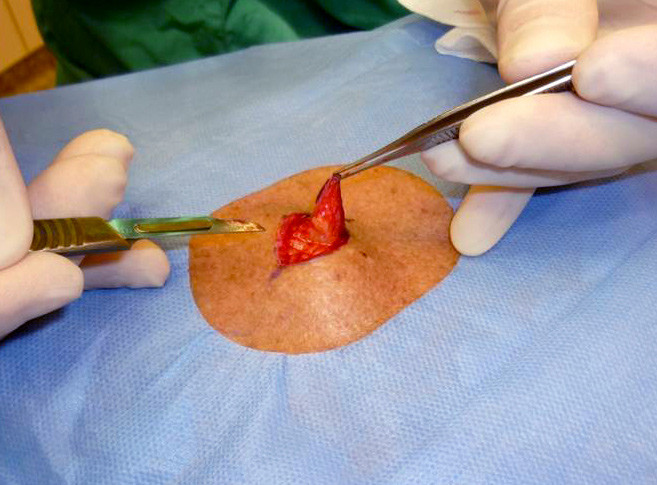
Extended excision
In recent years, the recommended excision distances for extended excision of histologically detected malignant melanoma have been reduced. The extended excision should be made down to the underlying fascia. It is the clinically measured distance from the tumour or scar that counts, and not the margin in the fixed material. Most of the defects arising when current recommendations are applied can be closed directly, i.e. without a skin graft. The skin margins recommended for extended excisions in Norway are shown in Table 1. The recommendations are based on large, prospective, randomised clinical studies that compare survival and local recurrences with different excision margins (12). Removal of malignant melanomas from the face, ears, fingers and toes and the soles of the feet is complicated and requires special surgical considerations (1).
Table 1
Skin margins recommended for extended excision in Norway (1)
| Type melanoma/Breslow thickness |
Excision width (in vivo) |
| In situ/lentigo maligna |
0.5 cm |
| ≤ 1 mm |
1 cm |
| 1.1 – 2 mm |
1 cm |
| 2.1 – 4 mm |
2 cm |
| > 4 mm/desmoplastic |
2 – 3 cm |
Suspicion of local recurrence and metastases
Patients with recurrence must be referred to a department of surgery that operates on patients with malignant melanoma, frequently a department of plastic surgery. The treatment is surgical as far as possible. Before surgery the patient undergoes tests with fine-needle aspiration cytology (FNAC), if possible in combination with image diagnostics (ultrasound/CT/PET-CT). Extended excision, lymph node dissection and excision of selected distant metastases are interventions that may be indicated.
Sentinel lymph nodes
Sentinel node procedure is now widely used in primary diagnosis of cutaneous malignant melanoma (13, 14). Inclusion in international studies is often pending on sentinel node procedures being conducted. The procedure in Norway is relevant for patients with extremity melanomas with a tumour thickness of 2 – 4 mm without ulceration (stage IIa, pT3a), or tumour thickness 1 – 2 mm and ulceration (stage IIa, pT2b) (1). There is a minor risk of lymph node metastases with thin melanomas, but the procedure is also being considered in Norway for patients with a tumour thickness of 1 – 2 mm. The procedure is additionally being considered for patients with melanomas of the trunk. The procedure should be performed at the same time as the extended excision. Melanoma patients who qualify for lymph node examination should undergo ultrasound examination of the axilla or groin. Patients with definite lymph node metastases can proceed directly to a lymph node dissection. The effect of sentinel lymph node diagnosis on survival has not been determined. Findings of metastases in sentinel lymph nodes do not affect overall survival, but increase the disease-free interval (15, 16).
Follow-up after surgery
Metastasis from malignant melanoma is seen most frequently to regional lymph nodes, while distant metastases occur in the skin, lungs, liver, skeleton, gastrointestinal system and brain. Most recurrences occur in the course of the first three years (1). Rare cases have been described of more than 30 years of latency before the metastases manifest themselves (2). In most cases monitoring can be carried out by the primary doctor. In cases of extensive atypical naevi or familial predisposition to malignant melanoma, some of the check-ups should be conducted by a dermatologist along with dermatoscopy of other pigmented lesions. The risk of recurrence is related to the thickness of the primary tumour, and follow-up should take this into account; see details in Robsahm et al. (1).
Local chemotherapy
Patients with multiple (inoperable) metastases to (only) one extremity may be suitable for intensive local chemotherapy (isolated limb perfusion) (17). Hyperthermia is applied together with intra-arterial melphalan hydrochloride, either alone or in combination with tumour necrosis factor (TNF). Patients who are to be assessed for this treatment must be referred directly to Oslo University Hospital, the Norwegian Radium Hospital, which is the national centre for this treatment in Norway.
Systemic therapy
Until recently no adjuvant treatment has proved to be life-extending. Everything from chemotherapy and various targeted treatments to different types of immunotherapy and combinations thereof have been tested, without an improvement in survival. Dacarbazine, temozolomide, vinblastine and chloroethyl-cyclohexyl nitrosourea (CCNU) remain «standard therapy», but all have very low response rates and none have proved to be life-extending (18) – (21). In recent years, however, completely new medical options have been developed which have radically changed treatment of malignant melanoma.
Immunotherapy
Ipilimumab is a human monoclonal antibody to cytotoxic T-lymphocyte antigen-4 (CTLA-4) (22). CTLA-4 normally inhibits T-cell activation. Ipilimumab accordingly potentiates T-cell activation. Ipilimumab and glycoprotein-peptide vaccine (Gp 100 vaccine) were tested in a three-arm study (23). The study included patients with inoperable stage III/IV melanoma with progression of the disease after systemic treatment (23). Ipilimumab resulted in significantly extended survival, the first drug ever to do so. Ipilimumab caused long-term survival that may last for several years (4 – 5 years) in over 20 % of the patients. The side effects of using the drug are autoimmune diseases, the most common being colitis, hepatitis, hypophysitis and dermatitis (23). On the basis of this study, the U.S. Food and Drug Administration (FDA) and the European Medicines Agency (EMA) approved ipilimumab for treating metastatic malignant melanoma. Marketing authorisation was issued on the condition that the manufacturer performed a phase IV trial. Such a trial is now in progress in Europe. In Norway, the Ministry of Health and Care has instead required that a national phase IV research study be conducted. Until the study gets under way, following approval by the Norwegian Medicines Agency and the Ethics Committee, all suitable patients with metastases from malignant melanoma will have the option of ipilimumab therapy. The drug and study costs are to be covered by a special grant from the national budget.
Combination therapy with ipilimumab and nivolumab (PD-1 antibody) is currently being tested in a phase III study after very promising results in a phase I study (24).
New, targeted treatment
The serine threonine protein kinase BRAF (v-raf murine sarcoma viral oncogene homologue B1) is mutated in many malignant melanomas. Activating mutations (e.g. BRAF-V600E) in tumour cells are found in about 50 % of all melanoma patients in Norway. The BRAF inhibitor PLX4032 (vemurafenib) acts selectively on cells that have BRAF-V600E mutations. Vemurafenib has shown response rates of approximately 50 % in phase I-II studies (25, 26).
Two multi-centre phase III studies with vemurafenib or dabrafenib versus dacarbazine as first-line treatment for patients with BRAF-V600E-positive tumours have shown that vemurafenib gives significantly longer survival, while dabrafenib results in significantly longer progression-free survival. Both drugs had high response rates (27, 28).
The most common adverse events were cutaneous events, alopecia, photosensitivity, fatigue, arthralgia and keratocanthoma/squamous cell carcinoma of the skin. If BRAF inhibitors are combined with MEK inhibitors, the response rate may be increased further, while the dermatological complications are reduced (29).
The clinical effect of BRAF inhibitors is seen in the course of days to a few weeks, i.e. more rapidly but is in general of shorter duration compared with immunotherapy.
Both vemurafenib and dabrafenib have been approved by the U.S. Food and Drug Administration and the European Medicines Agency. Both drugs are used in tablet form and can be prescribed following an application to the Norwegian Health Economics Administration (HELFO) for individual reimbursement.
Radiotherapy
Radiotherapy has no place in the treatment of primary malignant melanoma, with the exception of locally advanced malignant melanoma and melanoma of the eye, where specialised radiotherapy can have a curative effect and preserve eye function (30). Radiotherapy (50 kV, X-ray) is also employed in cases of large lentigo maligna melanomas of the face.
Post-operative radiotherapy should be considered in cases of uncertain radicality, when re-operation is not an option, for example after extirpation of a local recurrence, after lymph node dissection without tumour-free resection surfaces, and in some cases of extra-nodular tumour growth. Studies indicate that patients with melanoma in the head-throat region and lymph node metastases on the neck, particularly with perinodal tumour growth, may benefit from post-operative radiotherapy (31). However, there is no documented survival effect for post-operative radiotherapy after lymph node dissection.
Radiotherapy may offer effective palliation and local control of inoperable metastases that would otherwise result in substantial local problems (2).
In patients suffering from metastases of malignant melanoma, radiotherapy should be considered in the following situations:
Cutaneous metastases that cannot be removed surgically and which give rise to symptoms
Skeletal metastases that cause pain and/or risk of fractures
Metastases that compress or compromise important structures, such as the spinal medulla, major nerves or nerve roots and central airways
Brain metastases. In cases of 1 – 3 brain metastases where surgery is not an option, stereotactic radiotherapy should be considered. Transient local control is seen in 85 – 90 % of the patients who receive this treatment (7). Patients usually have multiple cranial metastases. Radiotherapy will then be required for the entire brain. This results in symptomatic improvement in 60 – 70 % of patients (2)
Solitary lung or liver metastases which lend themselves to stereotactic radiotherapy (see national guidelines for details) (1)
Melanoma in the eye and other rare melanomas
Five per cent of all melanomas have their origin in the eye, including the neighbouring areas of the conjunctiva, orbit and eyelid (1). Uveal melanoma is the most common primary malignant eye tumour in adults (Fig. 4). This location is also the second most common for a melanoma (after cutaneous melanomas). The tumour may be located in the iris (5 %), ciliary body (10 %) or choroid (85 %) (1). The incidence of uveal melanoma is 5 – 8 per million inhabitants per year, i.e. about 30 – 40 new cases each year in Norway (1).
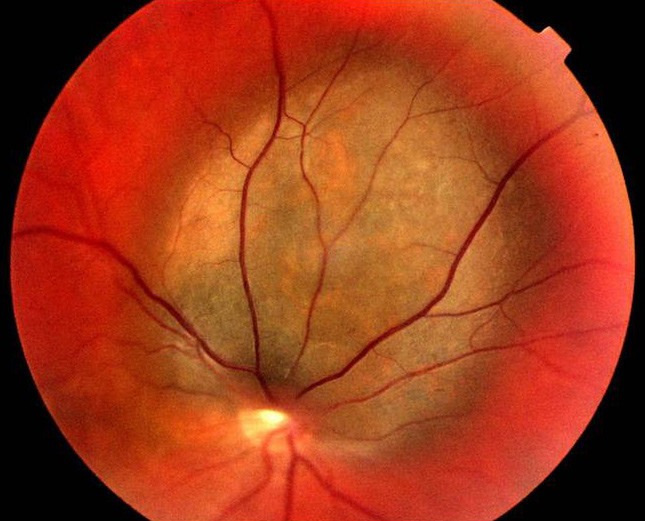
Despite progress in diagnostics and effective laser therapy, mortality due to uveal melanoma has remained unchanged for the past 50 years (1). In non-selected materials, the mortality is about 50 % after ten years. In cases of uveal melanoma, a malignancy assessment in the form of a thorough clinical examination, ultrasound of the abdomen, X-ray thorax, liver function tests and ordinary blood status must be performed within two weeks. It is difficult to determine the prognosis at an individual level. The symptoms of uveal malignant melanoma are non-specific and depend on the location of the tumour in the eye.
Today episcleral brachytherapy is the treatment that is best documented and most widely used internationally. According to the literature, up to 90 % of those treated can expect to still have their own eye after ten years, cosmetically fine and without major discomfort (1). The radiation source is sewn onto the sclera, corresponding exactly to the location of the tumour inside the eye.
There are two centres in Norway that are responsible for diagnosis, treatment and follow-up of all malignant intraocular tumours (Oslo University Hospital and Haukeland University Hospital).
Only 2 % of patients have detectable metastases at the time of diagnosis (1). The liver is the most frequently affected and the most crucial organ in connection with metastasis.
For treatment of other, rare locations of primary malignant melanoma (mucous membranes in the head-throat region, small intestine, genitals etc.) see Nasjonale retningslinjer for diagnostikk, behandling og oppfølging av maligne melanomer [National Guidelines for the diagnosis, treatment and follow-up of malignant melanoma](1).
The article is published by the Norwegian Melanoma Group, of which all the authors are members. All the authors have also contributed to the Norwegian Directorate of Health's guidelines for the diagnosis, treatment and follow-up of malignant melanoma ().
MAIN POINTS
Each year approximately 1 500 patients in Norway develop malignant melanoma, and 80 – 90 % of them will be cured with early and appropriate surgery.
Patients suffering from local recurrence may be cured in some cases if they receive early surgical treatment.
Standard chemotherapy may stabilise the disease for short periods in 5 – 10 % of the patients who have metastatic disease.
Serious side effects and the high costs of the new drugs have led to extensive discussion in Norwegian and foreign media.
- 1.
Robsahm TE, Johannesen TB, Bachmann IM et al. Nasjonale retningslinjer for diagnostikk, behandling og oppfølging av maligne melanomer. Oslo: Helsedirektoratet, 2011.
- 2.
Balch CM. red. Cutaneous melanoma. St. Louis, MO: Quality Medical Pub, 2010.
- 3.
Cancer in Norway 2010. Cancer incidence, mortality, survival and prevalence in Norway. Oslo: Kreftregisteret, 2012.
- 5.
International Agency for Research on Cancer Working Group on artificial ultraviolet (UV) light and skin cancer. The association of use of sunbeds with cutaneous malignant melanoma and other skin cancers: a systemic review. Int J Cancer 2007; 120: 1116 – 22. [PubMed]
- 10.
GenoMEL. www.genomel.org (17.7.2013).
- 12.
Sladden MJ, Balch C, Barzilai DA et al. Surgical excision margins for primary cutaneous melanoma. Cochrane Database Syst Rev 2009; nr. 4: CD004835. [PubMed]
- 14.
Garbe C, Terheyden P, Keilholz U et al. Treatment of melanoma. Dtsch Arztebl Int 2008; 105: 845 – 51. [PubMed]
- 18.
Middleton M, Hauschild A, Thomson D et al. Results of a multicenter randomized study to evaluate the safety and efficacy of combined immunotherapy with interleukin-2, interferon-alpha2b and histamine dihydrochloride versus dacarbazine in patients with stage IV melanoma. Ann Oncol 2007; 18: 1691 – 7. [PubMed] [CrossRef]
- 19.
Schadendorf D, Ugurel S, Schuler-Thurner B et al. Dacarbazine (DTIC) versus vaccination with autologous peptide-pulsed dendritic cells (DC) in first-line treatment of patients with metastatic melanoma: a randomized phase III trial of the DC study group of the DeCOG. Ann Oncol 2006; 17: 563 – 70. [PubMed] [CrossRef]
- 21.
Middleton MR, Grob JJ, Aaronson N et al. Randomized phase III study of temozolomide versus dacarbazine in the treatment of patients with advanced metastatic malignant melanoma. J Clin Oncol 2000; 18: 158 – 66. [PubMed]
Til tross for at stadig mer effektive solkremer er tatt i bruk de siste 50 årene, er forekomsten av malignt melanom 8-doblet siden Kreftregisteret ble opprettet i 1952. Rådene om måtehold og solforbrenning er ganske godt kjent i befolkningen, men resultatene fra Kreftregisteret kan indikere at rådene ikke er korrekte. Det synes ikke å være sikker sammenheng mellom dose og respons når det gjelder soling. Bruk av høy solfaktor innebærer at man kan oppholde seg i sterk sol mange flere timer enn man kunne på 50-tallet, og antall soltimer er derfor kanskje viktigere enn overdose av UV-bestråling. Og for alle som bor eller har bodd i Nord-Norge, er det neppe noen nyhet at solskade er vanskelig å pådra seg på disse breddegradene.
Malignt melanom - diagnostikk, behandling og oppfølging i Norge
I det siste tidsskriftet (nr. 20/2013) står det en interessant oversiktsartikkel basert på oppdatert kunnskap om diagnostikk, behandling og oppfølging av malignt melanom. Hovedbudskapet fokuserer på at det per i dag ikke eksisterer annen kurativ behandling enn kirurgi både når det gjelder primærtumor og ved metastatisk sykdom, men at både lokal og generell cytostatikabehandling samt strålebehandling kan stabilisere sykdommen i kortere perioder. Artikkelen henviser til det nasjonale handlingsprogramet for maligne melanomer utgitt av Helsedirektoratet i 2011,men verken der eller i oversiktsartikkelen nevnes ultralyd som nyttig verktøy i primærdiagnostikken av maligne melanomer.
Man vet at ca. 15% av pasientene med kutane melanomer debuterer med metastatisk sykdom. Dette kan være satelitter (tumorreder eller knuter < 2 cm fra primærtumor), in-transit metastaser (tumorreder eller knuter i hud eller underhud > 2 cm fra primærtumor, men innenfor området for regionale lymfeknuter), regionale lymfeknutemetastaser, fjernmetastaser, en kombinasjon av disse, eller kun metastaser uten synlig primærtumor. Ved overfladisk tumor uten ulcerasjon er det liten fare for at det allerede ved debut foreligger spredning,mens spredningsfaren absolutt er til stede ved ulcerasjon uansett tumortykkelse. Det samme gjelder nodulære melanomer som man vet metastaserer tidlig. I dag er det mulig å påvise helt ned til under 1 mm-store subcutane satelitter og in-transitt metastaser ved bruk av høyfrekvent (15-18mHz) ultralyd, men artikkelen nevner ikke ultralyd som nyttig verktøy med henblikk på diagnostikk av slik spredning i lokalområdet.
Det presiseres i artikkelen at korrekt kirurgisk prosedyre er ekstremt viktig for kurativ behandling. Vi er enige i at primæreksisjon av overfladiske melanomer uten ulcerasjon godt kan foretas i primærhelsetjenesten uten supplerende undersøkelser siden det er svært liten fare for at det allerede foreligger spredning. Hvis det imidlertid ved inspeksjon foreligger et melanom med ulcerasjon eller en nodulær tumor, eller histopatologisk vurdering av fjernet tumor viser at det er nødvendig med utvidet eksisjon, mener vi at det før eksisjon bør gjøres ultralydundersøkelse av lokalområdet for evt å påvise satelitter eller in-transit metastaser. Gir ultralyd mistanke om dette, bør pasienten henvises direkte til kirurgisk avdeling som opererer pasienter med malignt melanom.
I forbindelse med vaktpostlymfeknuteundersøkelse ved ekstremitetsmelanomer (sentinel node procedure) skriver forfatterne at aksille eller lyske bør undersøkes med ultralyd. Vi mener at det ikke er godt nok. Både primærtumors lokalområde, den regionale lymfeknutestasjonen og området mellom disse bør undersøkes, evt supplert med ultralydveiledet cytologisk biopsi (FNAC) ved mistanke om metastaser.
Først når ultralyd tas med i utredningen av maligne melanomer hvor det allerede ved debut foreligger fare for spredning, har kirurgen de beste forutsetningene for å utføre en mest mulig korrekt kirurgisk prosedyre hvilket gjør det potensielt mulig å helbrede pasienten.
Medlemmene i den Norske Melanom Gruppen takker kommuneoverlege Oddmund Suhrke for en relevant kommentar. Vi er enige med Suhrke i at bruk av solkrem i enkelte tilfeller muligens kan virke mot sin hensikt dersom resultatet blir i praksis en betydelig forlenget eksponering til UV-stråling. På den andre siden foreligger det en prospektiv studie som kan tyde på at regelmessig bruk av solkrem (solfaktor 16) kan forebygge utvikling av maligne melanomer (1).
Dessverre er det ikke lengre slik at høye rater av maligne melanomer er forbehold Sør-Øst Norge. De siste årene har f. eks. Trøndelagsfylkene hatt en svært høy økning av maligne melanomer som ikke kan forklares med sterk trøndersol alene, men må ses i sammenheng med endrete reisevaner etc.
Vi mener at det ikke er grunn til å tvile på at kreftforeningens solvettregler er korrekte, men dessverre er det slik at ikke alle følger reglene til enhver tid.
Her kommer solvettreglene én gang til:
1. Ta pauser fra solen (f. eks. mellom kl. 12 og 15) - unngå å bli solbrent
2. Bruk klær, solhatt og solbriller
3. Bruk solkrem med minst faktor 15
4. Unngå solarium (solarium frarådes for alle under 18 år!)
Litteratur:
1. Green AC, Williams GM, Logan V, Strutton GM. Reduced melanoma after regular sunscreen use: randomized trial follow-up. J Clin Oncol 2010; 29: 257-263.
Kommentaren skrevet av Heilo & Håskjold berører ett av mange viktige, men hittil ubesvarte spørsmål: Hvor mye diagnostikk er nødvendig og tilstrekkelig for pasienter med maligne melanomer? Ultralydundersøkelser blir allerede i dag brukt som et ledd i diagnostikken av maligne melanomer og virker lovende i noen situasjoner. På den andre siden stiller man i dag høye krav til nye medikamenter, og omfattende dokumentasjon fra store kliniske studier er nødvendig mens man ser på kost-nytte-verdien etc. Vi mener at nye diagnostiske muligheter er viktige og burde utvikles og evalueres på like fot med nye medikamenter før disse anbefales til alle melanompasienter (f.eks. i våre nasjonale anbefalinger). Kliniske studier som avklarer nytteverdien av (f.eks. høyfrekvente) ultralydundersøkelser (innflytelse på residivrisikoen eller totaloverlevelsen) ønskes derfor velkommen!
Norsk Melanom Gruppe