Schizophrenia is a severe disorder with a lifetime prevalence of approximately 1 %. The underlying pathophysiology is unknown. There are currently no «objective» measurable criteria for diagnosing schizophrenia, but it is common to include radiological examinations such as computerised tomography (CT) or magnetic resonance imaging (MRI) of the head, primarily to exclude cerebral somatic causes of psychotic symptoms and changed behaviour. But can MR imaging of patients with schizophrenia tell us anything more than the presence or absence of organic brain pathology? Can ever more sophisticated MRI post-processing tools and ultrahigh resolution MR images increase our knowledge of the pathophysiological mechanisms related to the disorder? Can MR images be used to distinguish between healthy and sick individuals?
The first in vivo brain scans of patients with schizophrenia were performed with pneumoencephalography (scanning of the ventricles) as early as 1927 (1). This was a painful procedure in which air was injected into the cerebrospinal canal, and one potential side effect was headache that could last for months (2). CT head scans, which came into use in schizophrenia research towards the end of the 1970s, were painless but exposed patients to large doses of radiation (3). The MR imaging procedures we use today are painless, do not expose patients to radiation and have no other side effects. This has made it possible to use repeated MRI scans to examine for research purposes large groups of patients and healthy control subjects. The number of scientific studies in which MR imaging has been used to examine anatomical changes occurring in schizophrenia has increased substantially in recent years. We will review this literature in the following.
Method
This article is based on a search in PubMed carried out in June 2012 using the search words “schizophrenia MRI». It is also based on the personal research and experience of the authors (all with PhDs within the field of MR imaging in schizophrenia). The literature search resulted in 4,099 hits. We have chosen to limit this article to structural MRI studies of schizophrenia patients, in other words we will describe and discuss anatomical, and not functional, changes. Delimiting the material in this manner will enable us to provide a more thorough overview of the field, maintain the desired level of accuracy, and stay within our own sphere of leading expertise. Structural MRI is moreover the type of imaging being ordered by psychiatric units today. Following a systematic review, we have excluded articles that do not deal with structural MRI (2,783 articles), that are not written in English (203 articles), and that do not include humans (278 articles). Of the remaining 835 articles, we present a subjective selection, based on relevance, size, methodological robustness and our knowledge of skilled and established research groups within the field. We have also included some of our own studies. To limit the list of references, we mention a number of sound meta-analyses and review articles, which will also serve as useful gateways to further in-depth studies in the subject.
Results
The pneumoencephalography studies in the 1920s and ’30s, and the CT research carried out in the 1970s and ’80s, showed already that patients with schizophrenia have larger brain ventricles than healthy control subjects at group level, and more recent MRI research has confirmed this (4). Cohen’s d can be used as a measure of the effect size when measuring differences between groups. d < 0.4 is considered a small effect, d = 0.4 – 0.8 medium, and d > 0.8 large. Meta-analyses show a moderately enlarged lateral ventricular volume in chronic schizophrenia (d = 0.49) (5) and in first-episode schizophrenia (d = 0.61 (left) and 0.47 (right)) (6). In a Norwegian subject sample we found a moderately enlarged ventricular volume (d = 0.41 (right) and d = 0.38 (left)) (7). One hypothesis is that an enlarged ventricular volume may be associated with volume diminution in other brain structures (8). It may be that when the volume of grey and white matter is smaller, the ventricular volume will be greater in order to «fill up» the intracranial volume.
Total brain volume has been used as an indirect measurement of structural integrity. Smaller total brain volume has been found in patients with schizophrenia compared with healthy control subjects (9), but subjected to meta-analysis the effect size is small (d = – 0.25) (5). Similarly, in another meta-analysis a smaller total volume (of 2.7 %) was reported in first-episode schizophrenia compared with healthy control subjects (10).
When the total volume is smaller and the ventricles enlarged, the question is whether there are certain regions or structures where the volume reduction is more pronounced. The following is a brief review of the best replicated findings (for illustration, see Figs. 1 and 2):
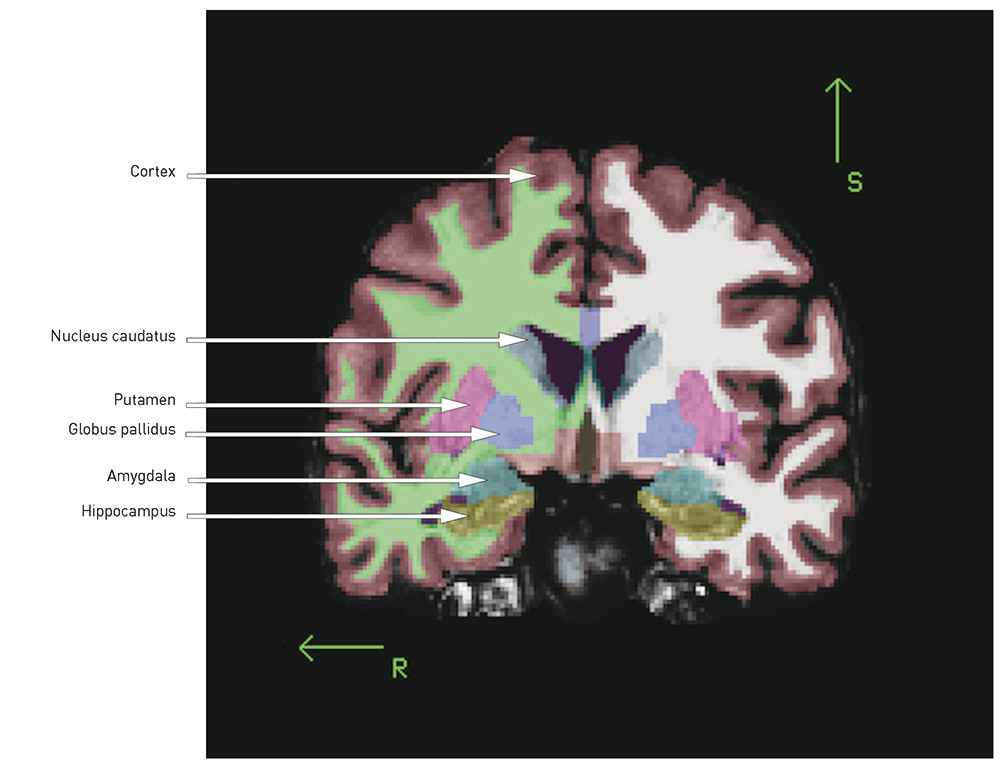
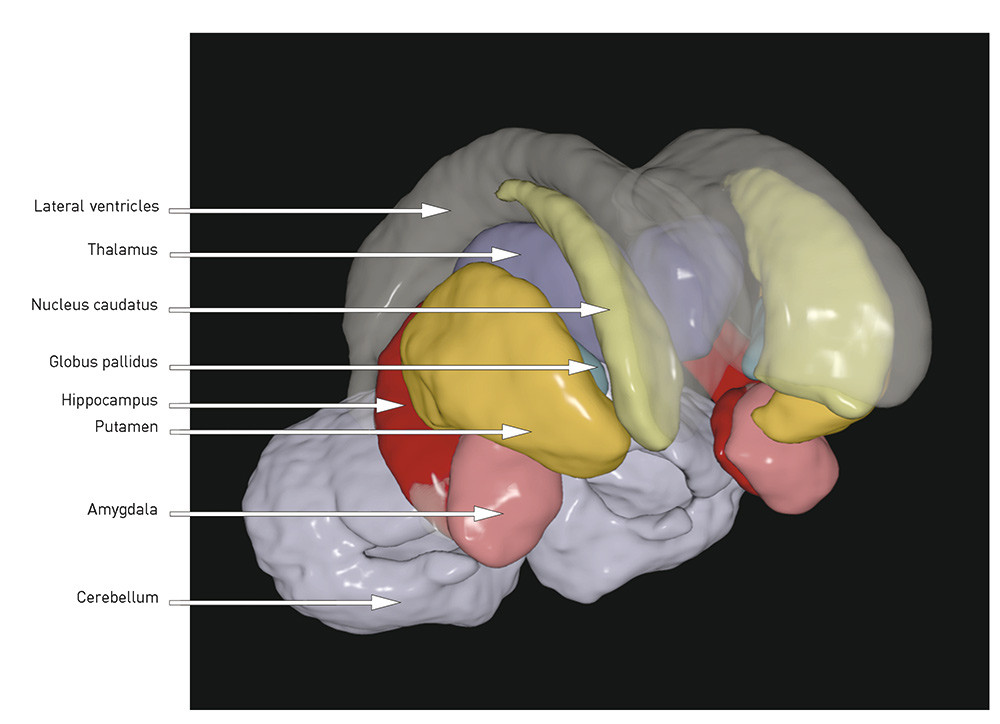
The hippocampus is located medially in the temporal lobe of the brain and is important for verbal learning and memory. It is generally reported to be smaller in patients with schizophrenia than in healthy control subjects (4, 9), a finding we have also reported from two Scandinavian cohorts (7, 11, 12). In a recently published meta-analysis of 44 MRI studies, the effect size was found to be medium (d = – 0.48 and – 0.53 for the left and right hippocampus respectively) (13), and there was no difference between first-episode and chronic schizophrenia. That the changes were present at onset of the illness may indicate that the hippocampal volume reduction in schizophrenia is developmentally related. The hippocampal volume reduction may represent a loss of grey matter, which may be significant for cognitive functions like learning and memory, which have been shown to be impaired in schizophrenia (14).
A number of studies, including our own (7, 11, 15), as well as several meta-analyses (5, 16, 17), have demonstrated in cases of schizophrenia an enlarged volume of the basal ganglia, especially pronounced in the globus pallidus. The basal ganglia are rich in dopamine fibres, and changes may therefore be difficult to interpret since the structures are affected by antidopaminergic antipsychotics (18).
The thalamus, a mid-line structure that borders on the ventricles, has proved to be smaller in patients with schizophrenia (19). In one meta-analysis, an effect size has been found of d = – 0.32 (right) and d = – 0.33 (left) in chronic schizophrenia and d = – 0.45 (right) and d = – 0.48 (left) in first-episode schizophrenia (20). The thalamus functions as a key node in the brain’s cognitive processes, and one hypothesis is that the flow of information between different areas of the brain is disrupted in schizophrenia (21).
The cortex is a complex structure with sulci and gyri. The neurons in the cortex are among other things involved in volitionally controlled and complex cognitive processes. The first MRI studies found a smaller cortical volume, particularly in the frontal and temporal lobes (4). This volume loss has been replicated in a number of later studies and may reflect a reduction of neuropil (unmyelinated nerve cells, synapses and glial cells), as has been found in neuropathological post mortem studies of schizophrenia patients (22). A smaller volume may be caused by a reduction in thickness and/or area (volume = thickness x area). In our group’s study from Oslo, we found a thinner cortex and a smaller area and volume in schizophrenia, where the changes in volume were «driven» by the reduction in thickness (23). This finding is consistent with several other studies that show a thinner cortex, most pronounced in the frontal and temporal areas, in schizophrenia (24) – (26).
Reduced cortical folding (gyrification) in schizophrenia has been found in a number of studies, but it has also been shown and replicated in other studies that one area in the right frontal lobe has increased gyrification (27) – (30). This is particularly interesting because the cortex folds naturally so that communicating areas come closer to one another (reducing the distance for nerve signals) (31). It is also known that gyrification takes place prenatally (31), which points towards the changes in cortical folding representing early developmental disorders. This in turn supports the theory that schizophrenia has an aetiology related to abnormal neurodevelopment.
Whether or not the anatomy of the brain changes over time in schizophrenia may say something about the underlying pathophysiology. Longitudinal changes in cortical thickness, but not in area, have been shown in schizophrenia (32), and it has been found that a reduction in cortical thickness over time correlates with the severity of the disorder (33). In first-episode schizophrenia, longitudinal reductions have been shown in the grey matter in the frontal lobe and thalamus and in the white matter in frontal, temporal and parietal areas. The changes were most evident in the first few years following onset of the disorder and were consistent with impaired cognitive function, but not with other symptoms (34). In one meta-analysis of 27 studies, longitudinal changes were found in both grey and white matter (35). It has been suggested that progressive changes may be related to the use of antipsychotics or may represent degenerative processes, but this is controversial. There is also some uncertainty as to whether there are real longitudinal changes or whether the findings represent methodological weaknesses.
Discussion
Initially, we asked three questions concerning what MR imaging can tell us about schizophrenia. We will in the following seek to answer those questions, based on the literature references.
Can MR imaging show more than organic brain pathology?
Our first question was: Can MR imaging of patients with schizophrenia tell us anything more than the presence or absence of organic brain pathology? The answer is yes. The volume of more or less all brain structures has in one or more studies been associated with schizophrenia. Thus, this might seem to indicate that patients with schizophrenia have massive changes in their brain anatomy, but that is not the case. The effect sizes are medium to small, and there is a high degree of overlap between sick and healthy individuals. Nevertheless, it has been established that patients with schizophrenia have a thinner cortex in some parts of the brain, as well as enlarged lateral ventricles and smaller hippocampal volumes – at group level – than healthy control subjects. We are seeing promising results in terms of diagnostic classification from studies using data-driven and advanced statistical methods (36, 37), although this is currently only at the research stage.
Can MR imaging show more with improved technology?
Within our own field of research, we are particularly interested in the second question: Is it possible with the aid of ever more sophisticated MRI post-processing tools and ultra-high resolution MR images to increase our knowledge of the pathophysiological mechanisms related to the disorder? The fact that in a number of studies changes have been found in the brain at the start of the illness suggests that schizophrenia is not a neurodegenerative disease. This has already been observed in neuropathological studies, in that no evidence of neuronal gliosis has been found in schizophrenia. Whether there are also progressive changes in brain anatomy in schizophrenia – and what in that event they represent – has not been established (see above). Most clinical studies to date have been done on 1.5 Tesla MRI scanners, but 3T MRI scanners are now taking over to a greater extent. They provide ultra-high resolution images, which permit more subtle differences to be detected between schizophrenia patients and control subjects. The software we use to analyse the images is becoming increasingly sophisticated. There are, for example, programs that measure cortical thickness, folding, and area at more than 300,000 points that together cover the entire surface of the brain. It is also possible to perform hippocampal segmentation in order to see the different subregions. This enhancement of the level of precision may make it possible to use MR images to understand more of the pathophysiological mechanisms of schizophrenia.
Can MR imaging distinguish sick from healthy individuals?
Finally, we will seek to answer the third question: If the differences between schizophrenia patients and control subjects are so slight and only present at group level, can we then use MR imaging to distinguish between sick and healthy individuals? Our review indicates that the answer for clinicians must be no. Schizophrenia is a clinical diagnosis. The only answer a researcher can give is – in all humility – that perhaps we will be able to, at some time in the future. At present, we can see features of schizophrenia in MR images, but not at the level of the individual.
MAIN POINTS
As a group, patients with schizophrenia have changes in a number of brain structures, including the cortex, hippocampus and ventricles
MR images of individual persons cannot be used for diagnostic purposes
Studying MR images may increase our understanding of the pathophysiology of schizophrenia
- 1.
Jacobi W, Winkler H. Encephalogrpische studien an chronischen schizophrenen. Arch Psychiatr Nervenkr 1927; 81: 299 – 332. [CrossRef]
- 2.
Leeds NE, Kieffer SA. Evolution of diagnostic neuroradiology from 1904 to 1999. Radiology 2000; 217: 309 – 18. [PubMed]
- 4.
Shenton ME, Whitford TJ, Kubicki M. Structural neuroimaging in schizophrenia: from methods to insights to treatments. Dialogues Clin Neurosci 2010; 12: 317 – 32. [PubMed]
- 5.
Wright IC, Rabe-Hesketh S, Woodruff PW et al. Meta-analysis of regional brain volumes in schizophrenia. Am J Psychiatry 2000; 157: 16 – 25. [PubMed]